Изследването на съдовата-тромбоцитите хемостаза
Нарушения в тази връзка на хемостаза може да продължи с тенденция към тромбоза или gemorragiam, В зависимост от това, което е избрано методи на изследване. Освен това, всички параметри на методите на изследване хемостаза е разделена на основни и напреднали, или втора линия тестове, които се прилагат само, Ако тестовете разкри всякакви нарушения. На основните (База) включва следните тестове.
Проби за устойчивост (фрактури) капиляри-manžetočnaâ, буркан, angiorezistometriâ
Повечето от тези тестове са достъпни и все още достатъчно информативни Примерни Кончаловски лост-Leede.
Оценката се базира на броя и размера на кръвоизливи, формира на върха на палмарно повърхност на предмишницата (в кръг с диаметър от 5 см) След 5 минути от изстискване рамото маншет налягане 12-13, 3 kPa (90-100 mm Hg. Чл.). Резултатите са взети предвид чрез 5 min след изваждане на маншета. Брой на petehij повече 10 точки за повишената крехкост на microvessels, Това често е свързана с тромбоцитопения или тромбоцитната функция angiotrofičeskoj нарушение. Също така взема предвид появата на кръвоизливи и под яка.
Примерни буркан работи на едни и същи области на кожата при stupeneobraznom сграда отрицателно налягане — от 20 кРа (150 мм Hg. Чл.) и по-ниско. При оценяване на резултатите, брои петехии, съгласно разпоредбите на банките.
Проби за продължителността и степента на капилярни кръвоизливи
Класически Дюк проба долната щанцоваща меката част на ухото, след като е пробита затопляне светлина на дълбочина от 3.5-4 мм. Кървене от времето, когато такова проучване обикновено не надвишава 4 м, капка кръв върху филтърна хартия са сравнително малки и започват да се свие за започващи с 1-1, 5 мин след пункция. Когато изразени trombocitopeniâh (по-малко 20 T в 1 л) и сериозни дисфункции тромбоцити кървене време нарасна до 20-40 мин, петна кръв са много по-големи и не намаляват или вълнообразни тогава намалена, след това отново се увеличи. Дюк делото недостатъчно чувствителни, аз н 2/3 пациенти с trombocitopatiâmi дава нормални резултати.
По-чувствителни проби, в която кървене време изследва фон е изкуствено създаден венозен застой, Какво е насложени върху рамото маншета на апарата за измерване на кръвно налягане и по време на изследване на налягането, равен 5,3 кРа (40 мм Hg. Чл.). Сред такива застой в пробата на Borchgrevink-Vaalera на палмарно повърхност на горната третина на предмишницата spayed skarifiktorom кръст щръбка дълбочина 1 mm и с дължина 8-10 мм (Норма кървене време е преди 10 м), и в пробата на Айви ЕТ. в същата област на предмишницата се поставя ланцет за вземане на кръв от пръста три странични пункция дълбочина 3 mm (Норма кървене време е преди 7 м).
На фона на една и съща венозна стаза възниква проучване на and. ОТ. Šitikovoj, в крайна сметка фаланга на пръст убождане се прилага в дълбочина 3 mm, и след това върхът на пръст потопена в чашата с 5 ml izotoniceski разтвор на натриев хлорид и кървене време при пропусната светлина (Ако разтворът много интензивно оцветени кръв, по-нататъшно наблюдение на пръст навлезе в друга купа). Размерът на кръвта, загубена се определя от нарастването на обема на течността в чаши (Норма кървене време е преди 4 м, обема на кръвта, загубена е от 0,01 към 0,4 мл).
В теста,. N. Suškeviču количеството на пропуснатите кръвта се определя чрез оцветяване амонячен разтвор (0,04 %) , в която са потопени документи с кръв петна, от kolorimetrirovaniâ на медицински kolorimetre.
Показанията на продължителността на теста на кървене, отклоняват от нормата, разкриват нарушение на Експресно thrombocytic съдовата хемостаза, Въпреки това, когато нормални резултати от тези проби не е изключено наличието на извън фокус, изразени от trombocitopatij.
Преброяване на броя на тромбоцитите в кръвта
Преброяване на броя на тромбоцитите в кръвта (в счетоводство камера Gorâeva с фаза контраст или оттенък или using елементарните частици броячи) е критичен начин за диагностициране на trombocitopenij и trombocitopatij, продължавате с постоянно или периодично намаляване на броя на тези клетки (аномалии, Бернар-Soulier, Мей-Hegglina и др.).
Преброяване на броя на тромбоцитите също предполага, могат да се предприемат допълнителни функционални и как тя трябва да се направи (с предварително концентрация на тромбоцити или без него, fotometričeski или под микроскоп и т. д.).
Изследването на тромбоцитите размери в намазка – trombotsitometriya
Изследването на тромбоцитите размери в намазка (trombotsitometriya) позволява ви да направи предварителна преценка на различните популации на тези клетки в кръвта на изследваните и получават информация за броя на техните аномалии, както и насищане на тромбоцитите гранули.
В някои trombocitopatiâh (Vizcotta синдром-Олдрич) в кръвта е доминиран от много малки тромбоцити (към 2 микрона в диаметър), други гигант форма (аномалии, Бернар-Soulier, Мей-Hegglina) - За да 8 М или по-. В редица trombocitopatij тези клетки бедни гранули (см. по-долу), Когато другият е счупен когато гранули на тромбоцитите rasplastyvanii централизация на стъкло, Това представлява нарушение на реакциите освобождаване гранули и вещества, съдържащи се в тях, необходими за изпълнението на хемостаза. Всички тези свойства, както и способността на тромбоцитите да процеси на изправяне и образуването, рейтинг структура на тези клетки могат да бъдат изследвани с помощта на конвенционални и сканираща електронна микроскопия, както и използването на смущения оптика на Nomarskomu.
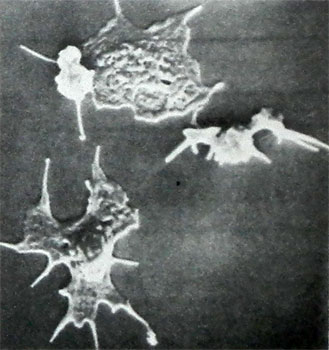
Кръвен съсирек прибиране естествено нарушен когато са изразени тромбоцитопения (по-малко от 30-40 g 1 л) и в някои форми на качествена малоценност на тромбоцити, по-често, отколкото не-trombocitoastenii Glanzmann, uremičeskoj thrombocytopathies, и т.н..
Проучване на лепило тромбоцитите функции на тромбоцити (AAFT)
Проучване на лепило тромбоцитите функции на тромбоцити (AAFT) е най-важната връзка в лабораторна диагностика на най-trombocitopatij. В настоящее время разработан ряд легко выполнимых и общедоступных методов исследования, включающий визуальную, микроскопическую и аппаратную (агрегометры, микрофильтры и др.) регистрацию этой функции к ориентировочным могут быть отнесены следующие методики.
Методы ретенции тромбоцитов на стекле (или фильтрах)
Проводится подсчет тромбоцитов в венозной крови до и после пропускания ее с о пределенной скоростью через стандартную колонку со стеклянными шариками или через косичку из стекловолокна; по убыли тромбоцитов из крови судят о степени их адгезивности.
Более доступен, хотя и несколько менее точен, метод определения числа тромбоцитов в крови до и после контакта ее в течение определенного срока с внутренней поверхностью колбы, вращающейся с определенной скоростью. Более точны методы определения задержки тромбоцитов на миллипорных фильтрах (диаметр пор — 15—20 мкм). При этих тестах оценка может проводиться по нарастанию градиента давления выше и ниже фильтра (закупорка пор тромбоцитами и их агрегатами ведет к увеличению этого показателя).
Методы исследования агрегационной функции тромбоцитов
Гемолизат-агрегационный тест основан на способности гемолизата отмытых эритроцитов, исследуемого в разведении 10-2 и 10-6, вызывать при помешивании агрегацию в его же плазме, одержащей большое количество тромбоцитов (соотношение объемов цитратной плазмы и гемолизата — 1,0:0,2). Учитываются время появления агрегации (норма при высокой концентрации гемолизата—11—17 с, при низкой — 40—54 с) и ее выраженность. Динамика процесса и его интенсивность могут оцениваться также фотометрически (медицинский колориметр, зеленый светофильтр, помешивание) и на агрегографе любой конструкции.
При графической регистрации процесса использование высокого разведения гемолизата (10-6) позволяет получить двухволновую агрегатограмму, в которой вторая волна связана с выходом из тромбоцитов эндогенных стимуляторов агрегации — АДФ, катехоламини, тромбоксана и др. Эта вторая волна характеризует реакцию освобождения, ее не наблюдается при отсутствии в тромбоцитах плотных гранул (съхранение басейн заболяване) или при нарушении реакции освобождения (аспириноподобный синдром и др.).
Гемолизат-агрегационный тест доступен для выполнения в любой лаборатории, не требует никаких специальных реактивов.
Визуальный микрометод определения агрегации тромбоцитов
Същността му се състои в това, что полученная в условиях силиконирования венозная кровь стабилизируется двойным объемом 3,8 % цитрата натрия (соотношение 2,4:0,6 мл), ее центрифугируют 6 минути при 100 об/ /мин, после чего полученную богатую тромбоцитами плазму наносят по 0,02 мл на предметные стекла и смешивают с таким же объемом агрегирующих агентов — АДФ, тромбином, колаген, норадреналином или ристомицином. Конечные концентрации агрегирующих агентов в исследуемой плазме крови должны составлять:
- ADF 0,5*10-4 ммол / л;
- норадреналина — 0,015%;
- тромбина — 0,125 ед/мл (концентрация коллагена подбирается опытным путем).
Возможно испытание как более низких, так и более высоких концентраций агрегирующих агентов. Подбор их концентрации может варьировать в зависимости от неодинаковой активности препаратов различного производства и при разной активности образцов, в связи с чем необходима предварительная подгонка концентрации каждого агента на нормальной плазме.
Смесь богатой тромбоцитами плазмы крови агрегирующего агента перемешивается покачиванием предметного стекла, на темном фоне с помощью лупы регистрируется время появления агрегатов в виде «снежной бури». При оценке результатов учитывается число тромбоцитов в плазме. Така, время АДФ-агрегации, возрастает с 27—37 с при 400 T в 1 л тромбоцитов до 62—75 с при 50 T в 1 л, а тромбин-агрегации — соответственно с 40—52 до 79— 106 от.
Графическая регистрация процесса агрегации
Графическая регистрация процесса агрегации под влиянием тех же агрегирующих агентов — весьма информативный метод функционального исследования тромбоцитов. Выполняется на агрегографах или.
При графической регистрации определяют не только время наступления агрегации, но и ее интенсивность (по величине отклонения кривой и площади агрегатограммы), наличие первой и второй волны агрегации — при использовании малых концентраций адреналина и АДФ (вторая волна характеризует реакцию освобождения), а также патологической дезагрегации.
Визуальное или графическое исследование агрегации тромбоцитов под влиянием ристомицина
Весьма важным является визуальное или графическое исследование агрегации тромбоцитов под влиянием ристомицина. Нарушается этот вид агрегации (конечная концентрация ристомицина 0,8—1,0 мг/мл) при одном из наиболее распространенных геморрагических диатезов — ангиогемофилии (болест на фон Вилебранд), а также при аномалии тромбоцитов Бернара—Сулье и при некоторых приобретенных видах угнетения синтеза фактора Виллебранда (уремия, иммунная ингибиция его и т. д.).
Количественное определение фактора Виллебранда в плазме крови
Количественное определение фактора Виллебранда в плазме крови проводится по ристомицин-агглютинации взвеси нормальных формалинизированных тромбоцитов в различных разведениях исследуемой бестромбоцитарной плазмы.
Метод важен как для диагностики ангиогемофнлии и вторичного угнетения синтеза этого фактора, так и для оценки тяжести поражения эндотелия (васкулит, атеросклероза и други.) и наклонности к тромбозам, при которых содержание фактора Виллебранда в крови часто значительно повышается.
Уровень фактора Виллебранда свидетельствует о способности эндотелия синтезировать его (снижен при аигиогемофилии) и о степени поражения эндотелия при васкулитах, атеросклерозе и других заболеваниях, протекающих с поражением внутренней оболочки сосудов.
Для получения фиксированных нормальных тромбоцитов к богатой тромбоцитами плазме крови здоровых лиц добавляются последовательно 0,2 % раствор ЭДТА (0,5 мл 5 мл плазмы) и 2 мин — фиксирующий раствор (20 мл 40 % формалина в 1000 мл фосфатного буфера с 0,2 г ЭДТА, pH 6,4).
Смесь выдерживается при температуре +4°С не менее 1 не, после чего она подвергается центрифугированию, удаляется надосадочная жидкость, а тромбоцитарный осадок дважды отмывается суспензирующим раствором (один объем 3,8 % раствора цитрата натрия и пять объемов изотонического раствора хлорида натрия; pH доводится до 7,4). Приготовленная взвесь нормальных формалинизированных тромбоцитов фасуется по 1 мл и хранится при температуре —20°С. Калибровочная кривая разведения строится с использованием бестромбоцитарной нормальной плазмы, с образцами которой смешиваются формалинизированные тромбоциты. Далее в смеси определяется ристомицин-агглютинация. По калибровочной кривой определяется количество фактора Виллебранда в исследуемой плазме крови. Фиксированные тромбоциты лучше сохраняются при добавлении в консервирующий раствор небольшого количества азида натрия.
Тестове, отражающие спонтанную агрегацию тромбоцитов
При обследовании больных с тромбоэмболиями или с повышенной наклонностью к тромбозу и ишемии в число основных методов включаются тесты, отражающие спонтанную агрегацию тромбоцитов, T. е. возникающую в цельной крови или в плазме крови без добавления агрегирующих агентов.
Для выявления этого феномена при микроскопии мазка крови обращается внимание на соотношение числа отдельно лежащих тромбоцитов и их агрегатов, состоящих из 3—5 тромбоцитов и более. Этот феномен лучше выявляется при просмотре осадка, полученного при интенсивном цеитрифу- гировании богатой тромбоцитами плазмы (20—30 мин при 6000 / Мин), стабилизированной цитратом или ЭДТА-цитратным раствором. Однако более стабильные результаты дают следующие методы определения спонтанной агрегации.
Метод Wu—Hoak
Метод Wu—Hoak основан на том, что кровь из вены набирается в две пробирки, в одной из которых содержится раствор ЭДТА, а в другой — смесь такого же раствора ЭДТА с 4 % разтвор на формалин. После перемешивания содержимое пробирок отстаивается 30 мин при стайна температура.
Во время отстаивания агрегаты оседают, а отдельные тромбоциты остаются в надосадочном слое. После отстаивания подсчитывается число тромбоцитов в надосадочном слое в каждой из пробирок. В норме разница в количестве тромбоцитов в содержимом обеих пробирок не превышает 10—15 %, при повышенной спонтанной агрегации она возрастает.
Метод Н. аз. Тарасовой
По методу Н. аз. Тарасовой (1984) убыль тромбоцитов из цельной цитратной крови в агрегаты учитывается после 3-минутного взбалтывания ее на встряхивателе АВУ-1 со скоростью 90—100 раз в 1 м.
В пробирку с 0,5 мл кръв, подвергавшейся встряхиванию, вводится 1 мл 1 % раствора формалина в изотоническом растворе хлорида натрия. Вторая пробирка с контролем не подвергается встряхиванию, и в содержащуюся в ней кровь того же исследуемого через 3 мин также вводится раствор формалина.
Кровь в обеих пробирках отстаивается 30 м, после чего в надосадочном слое подсчитывается число тромбоцитов. В норме разница в количестве тромбоцитов не превышает 20 %, при повышенной наклонности к агрегации она возрастает.
В случаях выявления нарушении при применении основных тестов, характеризующих тромбоцитарный гемостаз, выполняют по мере необходимо провести дополнительные исследования. Из них наиболее важны следующие.
Дополнительные исследования для определения тромбоцитарного гемостаза
Исследование количества мегакариоцитов в миелограмме и трепанате костного мозга с изучением морфологии этих клеток
Значительное увеличение числа мегакариоцитов в срезах костного мозга, обычно сочетающееся с более или менее выраженным увеличением количества тромбоцитов в крови, наблюдается при эритремии, геморрагическом и эссенциальном тромбоцитозе и других миелопролиферативных заболеваниях. Умеренный мегакариоцитоз, сочетающийся с тромбоцитопенией, характерен для тромбоцитопенической пурпуры (болезни Верльгофа).
При аплазии и гипоплазии костного мозга любого генеза снижено как содержание мегакариоцитов в срезах костного мозга, так и количество тромбоцитов в периферической крови.
Парциальный амегакариоцитоз наблюдается при дефиците тромбоцитопоэтина (редкая форма врожденной тромбоцитопении), появлении в крови антимегакариоцитарных антител, эссенциальной парциальной аплазии мегакариоцитов (может предшествовать развитию лейкоза).
Морфологические и цитохимические изменения мегакариоцитов отмечаются при многих тромбоцитопатиях.
Электронно-микроскопическое изучение ультраструктуры тромбоцитов
Электронно-микроскопическое изучение ультраструктуры тромбоцитов имеет значение для диагностики ряда тромбоцитопатий, при которых отсутствуют или резко уменьшается количество небелковых гранул высокой оптической плотности (содержащих АДФ, серотонин, катехоламини, кальций и др.), либо белковых α-гранул, что характерно для ряда тромбоцитопатий, объединяемых в группу болезней пула хранения, или болезней отсутствия гранул.
Могут выявляться также дефекты в контрактильном аппарате (системе микротрубочек) и лизосомах тромбоцитов.
При сканирующей электронной микроскопии или исследовании тромбоцитов с помощью интерференционной оптики по Номарскому могут обнаруживаться также дефекты фиксации тромбоцитов на чужеродной поверхности, их распластывания на ней, образование отростков, централизация и секреция гранул, что характерно для многих видов тромбоцитопатий.
Определение антитромбоцитарных антител путем иммунофлюоресцент- ного исследования в суспензии тромбоцитов иммуноглобулина, связанного с этими клетками – метод Диксона
Этот сложный метод позволяет дифференцировать иммунные и неиммунные тромбоцитопении.
Однако при наиболее выраженных формах заболевания с резкой тромбоцитопенией он неприемлем, так как для определения связанного иммуноглобулина требуется достаточно большое (более 40—50 Г в 1 л) броя на тромбоцитите.
Определение продолжительности жизни меченых аутологичных тромбоцитов
Определение продолжительности жизни меченых аутологичных тромбоцитов позволяет разграничивать тромбоцитопении с нормальной продолжительностью жизни тромбоцитов в циркуляции (около 9 Нощем) и формы заболевания с укороченной продолжительностью жизни этих клеток.
Первые чаще всего связаны со снижением продукции тромбоцитов в костном мозге, вторые — с их ускоренной гибелью, либо с действием антитромбоцитарных антител (при аутоиммунных тромбоцитопениях продолжительность жизни тромбоцитов сокращается до нескольких часов), либо с интенсивной убылью этих клеток в агрегаты и тромбы при диссеминированном внутрисосудистом свертывании крови или массивных тромбозах (тромбоцитопении потребления).
Количественное определение содержания в плазме крови до и после агрегации тромбоцитарных факторов
Количественное определение содержания в плазме крови до и после агрегации ряда тромбоцитарных факторов — мембранного фосфолипидного фактора 3, содержимого α-гранул (антигепаринового фактора 4, б-тромбоглобулина, митогенного фактора тромбоцитов) и небелковых гранул высокой электронно-оптической плотности (Серотонинът, катехоламини, ADF), а также кислых гидролаз.
Эти исследования дают представление о содержании в тромбоцитах соответствующих структур и их компонентов, об освобождении их в плазму в процессе агрегации, а также о внутрисо- судистой активации тромбоцитов, сопровождающейся выходом из тромбоцитов в плазму крови с повышением концентрации в последней компонентов плотных и α-гранул (антигепаринового фактора 4, β-тромбоглобулина и др.).
Методы количественного исследования тромбоцитарных факторов важны для идентификации ряда тромбоцитопатий (нарушений сохранности гранул и их компонентов, пареза реакции освобождения этих компонентов, повышения содержания их в плазме крови вследствие интенсивной внутри- сосудистой адгезии и агрегации тромбоцитов и др.). Ряд тромбоцитопатий характеризуются снижением содержания в мембранах тромбоцитов фактора 3 либо нарушением его доступности для участия в процессе свертывания крови.
Исследование биохимических особенностей тромбоцитов и отдельных их структур
Исследование биохимических особенностей тромбоцитов и отдельных их структур — стромы, гранули, митохондрий и т. д. позволяют документировать связь разных видов патологии и дисфункции тромбоцитов с определенными видами ферментной недостаточности (COX дефицит, тромбоксансинтетазы и пр.), с нарушением состава мембранных липопротеинов, необходимых для взаимодействия с агрегирующими агентами, и Т. д.
Подобные исследования доступны лишь хорошо оснащенным исследовательским лабораториям и поэтому в широкой практике не применяются.
