Сосудисто-тромбоцитарный гемостаз – Hệ thống đông máu
Эндотелий, выстилающий внутреннюю поверхность кровеносных сосудов, обладает высокой тромборезистентностью и играет важную роль в сохранении жидкого состояния циркулирующей крови. Это свойство эндотелия связано со следующими его особенностями:
- способностью образовывать и выделять в кровь мощный ингибитор агрегации тромбоцитов — простациклин (метаболит арахидоновой кислоты, относящийся к простагландинам);
- продукцией тканевого активатора фибринолиза;
- неспособностью к контактной активации системы свертывания крови;
- созданием антикоагулянтного потенциала на границе кровь/ткань путем фиксации на эндотелии комплекса гепарин — антитромбин III;
- способностью удалять из кровотока активированные факторы свертывания крови.
Вместе с тем стенка сосудов в силу своих анатомо-физиологических особенностей — ригидности, эластичности, пластичности и других — способна противостоять не только давлению крови, но и умеренным внешним травмирующим воздействиям, в силу чего они препятствуют возникновению геморрагий. Tài sản này, как и способность противостоять выходу эритроцитов из капилляров путем диапедеза, t. nó là. через механически неповрежденную стенку сосудов, зависит от полноценности эндотелия и от особенностей строения субэндотелиального слоя — степени развития и качества коллагена и микрофибрилл, соотношения коллагеновых и эластических волокон, структуры базальной мембраны и т. d. Эти свойства в значительной степени зависят от количества и качественных особенностей тромбоцитов, в силу чего при недостаточном их содержании в крови и (hoặc) при тромбоцитопатиях усиливаются как диапедезная кровоточивость, так и ломкость микрососудов: легко возникают петехии и кровоподтеки, становятся положительными пробы на ломкость капилляров — щипка, манжеточная, баночная по А. VÀ. Нестерову и др.
Микрососуды отвечают на повреждение выраженным локальным спазмом — рефлекторным и связанным с освобождением из стенок сосудов и тромбоцитов адреналина, noradrenaline, серотонина и других биологически активных веществ.
Повреждение стенки сосудов và, đặc biệt, оголение субэндотелия способствуют активации свертывания крови и тромбоцитарного гемостаза несколькими путями:
- выделением в кровь тканевого тромбопластина (yếu tố III, apoprotein C) и других активаторов свертывания и агрегации тромбоцитов — адреналина, noradrenaline, АДФ и др.;
- контактной активацией коллагеном и другими компонентами субэндотелия как тромбоцитов (адгезия), так и свертывания крови (активация фактора XII);
- продукцией плазменных кофакторов адгезии и агрегации тромбоцитов — фактора Виллебранда и др.
Như vậy, стенка сосудов тесно связана и взаимодействует со всеми другими звеньями системы гемостаза, особенно с тромбоцитами.
Участие тромбоцитов в гемостазе определяется в основном следующими их функциями:
- ангиотрофической — способностью поддерживать нормальную структуру и функцию микрососудов, их устойчивость к повреждающим воздействиям, непроницаемость по отношению к эритроцитам;
- способностью поддерживать спазм поврежденных сосудов путем секреции (реакции освобождения) вазоактивных веществ — адреналина, noradrenaline, серотонина и др.;
- способностью закупоривать поврежденные сосуды путем образования первичной тромбоцитарной пробки (тромба), включающей приклеивание тромбоцитов к субэндотелию (адгезивная функция), склеивание их друг с другом и образование комков из набухших тромбоцитов (агрегационная функция), а также синтез, накопление и секрецию при активации веществ, стимулирующих адгезию и агрегацию;
- тромбопластической — способностью тромбоцитов выделять гемостатические факторы.
Все приведенные данные позволили обосновать учение о единстве сосудисто-тромбоцитарного, или первичного, гемостаза. Основанием для этого учения послужило классическое исследование Дьюка, показавшее, что время кровотечения при проколе кожи мочки уха иглой или скарификатором (проба Дьюка) закономерно увеличивается при выраженной тромбоцитопении, но остается нормальным или почти нормальным при глубоких нарушениях свертываемости крови (ví dụ:, при гемофилии). Những thông tin này, получившие полное подтверждение в дальнейших исследованиях, позволили сделать вывод, что первичный гемостаз в микрососудах осуществляется в основном за счет тромбоцитов. При этом выраженное увеличение времени кровотечения регистрируется не только при значительной тромбоцитопении (менее 30—50 Г в 1 l), но и при тяжелых формах качественной неполноценности тромбоцитов (Glanzmann thrombasthenia, тромбоцитопатии), а также при дисфункциях этих клеток вторичного генеза — из-за дефицита плазменных кофакторов адгезии и агрегации или наличия в плазме ингибиторов этих функций (парапротеинов, продуктов протеолиза и др.).
Среди наследственных форм вторичной дисфункции тромбоцитов наиболее важной и распространенной в клинической практике является angiogemofilija (bệnh von Willebrand), при которой время кровотечения увеличивается до 0,5—1 ч и более, а из приобретенных форм — нарушения функции тромбоцитов при диссеминированном внутрисосудистом свертывании крови (тромбоцитопатия потребления, повреждающее действие продуктов протеолиза), уремии, приеме лекарственных средств (aspirin, antykoahulyantы, фибринолитики и др.).
Формирование тромбоцитарной пробки и остановка кровотечения из микрососудов завершается при проведении пробы Дьюка за 2—4 мин, а при создании дополнительного венозного стаза (наложение манжеты с давлением 5,3 kPa, hoặc 40 mm Hg. Art., và hơn thế nữa) — за 6—10 мин.
Ведущая роль в реализации первичного гемостаза принадлежит адгезивно-агрегационной функции тромбоцитов (AAFT).
В настоящее время достаточно хорошо изучены основные механизмы ААФТ, разработаны доступные лабораторно-инструментальные методики ее исследования. Чаще всего пусковую роль в этом процессе играет повреждение стенки кровеносных сосудов, вследствие чего тромбоциты вступают в контакт с субэндотелием, в частности — с главным стимулятором адгезии коллагеном, sưng lên, образуют отростки и приклеиваются (адгезируют) на этих участках.

Важнейшими плазменными кофакторами этого процесса являются ионы кальция и синтезируемый в эндотелии белок—yếu tố von Willebrand (yếu tố VIII: rKOF) а в тромбоцитах — взаимодействующий с фактором Виллебранда мембранный гликопротеин Tôitrong (ГП-Tôitrong).
В связи с этим дефицит фактора Виллебранда (angiogemofilija, hoặc bệnh nhân von Willebrand) или ГП-Iв (trombotsitodistrofiya, или болезнь Бернара—Сулье) сопровождается резким нарушением адгезивности тромбоцитов.
Наряду с адгезией протекает процесс агрегации тромбоцитов — набухания и склеивания их между собой с образованием отростков и с наложением агрегатов на участок повреждения сосуда, в силу чего гемостатическая пробка или тромб быстро растет.
Первичный стимул к агрегации дают коллаген, выделяющийся из поврежденных стенок сосудов, и в еще большей степени АДф из гемолизирующихся в зоне повреждения эритроцитов, катехоламины и серотонин (L. 3. Баркаган, B. F. Архипов, 1980, 1983).
Из тромбоцитов, подвергающихся адгезии и агрегации, активно секретируются гранулы, которые содержат вещества, усиливающие процесс агрегации и формирующие ее вторую волну. Bao gồm các небелковые гранулы высокой электронно-оптической плотности, содержащие в большом количестве АДФ, thận tuyến tố, норадреналин и серотонин, а также α-гранулы, содержащие белки — антигепариновый фактор (hệ số 4), β-тромбоглобулин, тромбоцитарный стимулятор роста (митогенный фактор) và vv.
Позднее секретируются гранулы, содержащие лизосомальные ферменты (реакция освобождения II).
В результате взаимодействия тромбоцитарных и плазменных факторов в зоне гемостаза образуется тромбин, малые дозы которого резко усиливают и завершают процесс агрегации и одновременно вызывают свертывание крови, в силу чего тромбоцитарный сгусток покрывается фибрином, приобретает большую плотность, подвергается ретракции.
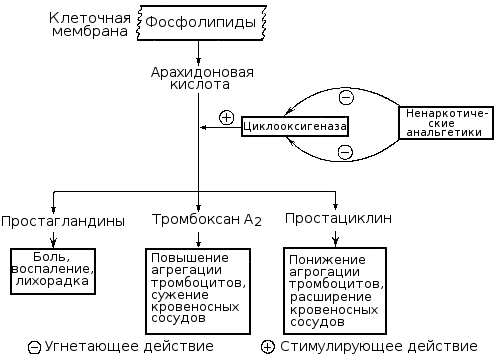
Чрезвычайно важную роль в регуляции тромбоцитарного гемостаза играют производные арахидоновой кислоты, освобождаемой из мембранных фосфолипидов тромбоцитов и стенки сосудов вследствие активации фосфолипаз.
В дальнейшем под влиянием циклооксигеназы из арахидоновой кислоты образуются prostaglandins (PGG2, PGH2), а из них в тромбоцитах под влиянием тромбоксансинтетазы вырабатывается чрезвычайно мощный агрегирующий агент — тромбоксан Một2 (TXA2), а в стенке сосудов под влиянием простациклинсинтетазы — основной ингибитор агрегации — простациклин (простагландин Tôi2, PGI2).
Нарушение образования тромбоксана A2 в результате снижения активности или блокады циклооксигеназы или тромбоксансинтетазы ведет к выраженному нарушению функции тромбоцитов, способствует развитию кровоточивости, что наблюдается при ряде наследственных и приобретенных (симптоматических) тромбоцитопатий. Нарушение же синтеза в стенке сосудов простациклина или ослабление его поступления в кровь ведет к повышенной склонности тромбоцитов к агрегации, создает тромбогенную опасность. Продолжительность активного действия тромбоксана, простациклина и родственных им других простагландинов небольшая (Một vài phút), но значение их в регуляции и патологии гемостаза весьма велико. В результате метаболизма они превращаются в неактивные производные — тромбоксан B2 и другие конечные продукты.
Theo các nhà khoa học, исследование которых легло в основу учения о простагландиновой регуляции тромбоцитарного гемостаза, этот механизм является пусковым в развитии адгезивно-агрегационной функции тромбоцитов. Активация тромбоцитарных мембран может осуществляться не только АДФ и тромбоксаном, но и гидроперекисями полиненасыщенных жирных кислот, образующимися в ходе свободнорадикального аутоокисления фосфолипидов.
Помимо перечисленных выше агентов, в тромбоцитах и в других активированных клетках крови (лейкоцитах и пр.) образуются и иные мощные стимуляторы агрегации. Из них в последние годы особое внимание уделяется фосфолипидному пластиночному агрегирующему фактору (PAF) из лейкоцитов и тромбоцитов, являющемуся 1-0-октадецил-2-ацетил-3-фосфорилхолином, а также содержащемуся в α- гранулах тромбоцитов гликопротеину G (тромбоспондин, эндогенный лектин). Этот фактор освобождается из тромбоцитов вместе с α-гранулами, фиксируется на поверхности активированных кровяных пластинок, образуя комплекс с фибриногеном, и в таком виде используется для осуществления тромбинагрегации. В силу этого при тромбоцитопатиях с отсутствием α-гранул (ví dụ:, при синдроме серых тромбоцитов) нарушается агрегация этих клеток под влиянием тромбина.
Для осуществления адгезивно-агрегационной функции тромбоцитов необходим ряд плазменных кофакторов агрегации — ионы кальция и магния, fibrinogen, альбумин и два белковых кофактора, именуемые агрексонами A и B, фосфолипидный кофактор и др.
Вместе с тем парапротеины, криоглобулины и продукты фибринолнза ингибируют агрегацию тромбоцитов. К белковым ингибиторам этого процесса относятся также простациклин – зависимый макромолекулярный белок, фактор Барнес—Лиана (резко снижается при тромботической тромбоцитопенической пурпуре) và vv.
В осуществлении агрегационной функции важную роль играют мембранные гликопротеины тромбоцитов, взаимодействующие с агрегирующими агентами.
Согласно рекомендациям Международного комитета по тромбозам и гемостазу, различают следующие основные виды мембранных гликопротеинов:
Гликопротеин I, состоящий из двух субъединиц — Ia и Ib. Первая из них является рецептором фактора Виллебранда и необходима для адгезии, а вторая — для тромбин-агрегации. Содержание гликопротеина I снижено при одной из вариантных форм ангиогемофилии и при тромбоцитодистрофия (Bệnh Bernard-Soulier).
Гликопротеин II, также состоящий из двух субъединиц, необходим для всех видов агрегации, содержание его (особенно IIb) резко снижено при тромбоцитоастении Гланцманна.
Гликопротеин III, одни из компонентов которого соединяется с гликопротеином IIb и кальцием, необходим для большинства видов агрегации и ретракции сгустков; содержание его снижено при тромбоцитоастении Гланцманна
Функциональное значение IV и V мембранных гликопротеинов нуждается в уточнении.