Механизм действия лекарственных веществ
В подавляющем большинстве случаев, чтобы лекарственное вещество (лиганд) оказало свое действие, оно должно в организме встретить специфические компоненты — мишени-рецепторы, молекулярные структуры, представляющие собой белковые, реже нуклеиновые кислоты, липидные или другие конфигурации, расположенные внутри или на поверхности клеток, с которыми оно взаимодействует, запуская цепь биохимических и физико-химических процессов, приводящих к определенному эффекту.
Имеется два вида мембранных рецепторов — ионные каналы и рецепторы, связанные с G-белком. Napríklad, для адетилхолина и подобных ему лекарственных веществ характерен натриевый канал. Ацетилхолин взаимодействует с канальным протеином, обуславливая в нем конформационные изменения, которые способствуют открытию канала и проникновению ионов натрия в клетку. Этот процесс лежит в основе нервного возбуждения. Niektoré lieky, взаимодействуя с белком натриевого канала, препятствуют его открытию, тем самым блокируют передачу нервного возбуждения.
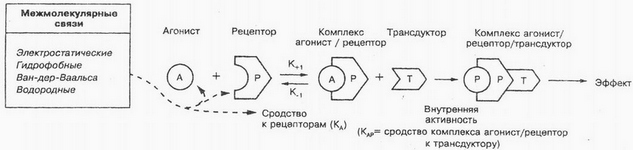
К внутренней части плазматической мембраны клеток присоединяется так называемый G-белок, который обеспечивает синхронизацию процесса взаимодействия лекарственного вещества с одновременной активацией соответствующих внутриклеточных белков-мишеней. Как показано на рисунке, молекула лекарственного вещества взаимодействует с рецептором (P) на внешней поверхности мембраны, которое обуславливает конформационные изменения рецепторного белка. Благодаря этому G -белок изменяет свою пространственную структуру, мигрирует в плоскости мембраны к ферментам, которые находятся в неактивном состоянии внутри клетки. Взаимодействие G -белка с ферментами (T) обуславливает их активацию (ЛВ/Р/Т). Noradrenalín, допамин и другие лиганды взаимодействуют именно с рецепторами, связанными с G -белком. Следует заметить, что ацетилхолин может взаимодействовать не только с канальным белком, но и с рецепторами, связанными с G -белком.
Для возникновения взаимодействия между лигандом и биорецептором необходимо, чтобы они обладали комплиментарностъю, то есть между ними должно существовать определенное сродство, или аффинитет (соответствие размеров, пространственной конфигурации, наличие противоположных зарядов и т. d.). Napríklad, положительному заряду экзогенного лиганда должен соответствовать отрицательный заряд рецептора, а неполярные радикалы вещества могут связываться с гидрофобными участками рецептора.
Среди физико-химических свойств лекарственных веществ, влияющих на их взаимодействие с рецепторами, следует выделить величину молекулы, в зависимости от которой вещество может взаимодействовать со всем рецептором или с его составной частью. От величины молекулы лекарственного вещества зависит и кинетика проникновения его через биологические мембраны. Обычно с увеличением размера молекулы повышается ее гибкость и возможность образования ван-дер-ваальсовых связей с макромолекулярным партнером. Okrem, важное значение имеет стереохимия молекулы лекарственного вещества. Z, в какой изомерной форме находится лекарственное вещество, зависит его фармакологическая активность. Причем нужно иметь в виду: чем жестче конформация молекулы рецептора, тем сильнее различие в действии стереоизомеров.
Взаимодействие лекарственное вещество — рецептор осуществляется за счет межмолекулярных связей. Вначале вещество притягивается к рецептору с помощью электростатических сил, а при наличии комплиментарности — образует с рецептором связи при помощи физических и физикохимических взаимодействий (характерно для лекарственных веществ, которые экскретируют из организма в неизменном или малоизмененном виде) или химических взаимодействий (присуще для соединений, которые подвергаются в организме химическим превращениям). Самые слабые ван-дер-ваальсовые силы принимают участие в определении специфичности взаимодействия лекарственного вещества с биохимическими реактивными системами. Водородные связи участвуют в процессах узнавания и фиксации вещества (лиганда) к биоструктурам. Ионные связи возникают в тех случаях, когда лекарственные вещества содержат катионную или анионную группу, а противоположные структуры находятся в биорецепторах. Часто ионные связи образуются на первых ступенях фармакологической реакции между веществами и рецепторами. В подобных случаях действие лекарства носит обратимый характер. Важное значение имеет образование координационных ковалентных связей. С их участием протекают взаимодействия алкилирующих агентов с биосубстратами, а также лекарств и антидотов с металлами при образовании стабильных комплексов-хелатов, napr, унитиола с мышьяком или тетацин-кальция со свинцом. Действие таких веществ носит необратимый характер.
Okrem, существует гидрофобное взаимодействие. Хотя энергия его связей мала, взаимодействие большого числа длинных алифатических цепей приводит к возникновению стабильных систем. Гидрофобные взаимодействия играют определенную роль в стабилизации конформаций биополимеров и образовании биологических мембран.
Аминокислотные остатки в белковой молекуле-рецепторе содержат полярные и неполярные группировки, которые детерминируют образование полярных и неполярных связей между ними и лекарственными веществами. Полярные группы (-OH, -NH, COO-, -N3H, =O) обеспечивают образование, hlavne, ионных и водородных связей. Неполярные группы (водород, метильные, циклические радикалы и др.) образуют гидрофобные связи с низкомолекулярными лекарственными веществами.
Tak, взаимодействие лекарственных веществ со специфическими рецепторами может осуществляться за счет различных химических связей, имеющих неодинаковую прочность. Tak, примерная прочность курареподобных веществ с холинорецепторами для электростатического (ионного) взаимодействия составляет 5 ккал/моль, ион-дипольного — 2-5 ккал/моль, диполь-дипольного — 1-3 ккал/моль, водородных связей — 2-5 ккал/моль, ван-дер-ваальсовых связей — 0,5 ккал/ моль, гидрофобных связей — 0,7 ккал на одну CH2-группу. Уменьшение прочности связи в зависимости от расстояния между атомами для электростатического взаимодействия составляет r-2, ион-дипольного — r-3, диполь-дипольного — r-4, водородных связей — r-4, ван-дер-ваальсовых связей — r-7. Такого рода связи могут нарушаться, что обеспечивает обратимость действия лекарственных веществ. Более прочными являются ковалентные связи, которые обеспечивают длительное и часто необратимое действие веществ, napr, алкилирующих противоопухолевых препаратов. Большинство лекарственных веществ соединяется с рецепторами обратимо. V čom, zvyčajne, характер соединения весьма сложен: в нем могут участвовать одновременно ионные, диполь-дипольные, ван-дер-ваальсовые, гидрофобные и другие виды связи, что во многом определяется комплиментарностью вещества и рецептора и, príslušne, степенью их сближения между собой.
Прочность связывания вещества с рецепторами обозначают термином «аффинитет». Látky, действующие на одни и те же рецепторы, могут обладать по отношению к ним разной степенью аффинитета. При этом вещества с более высоким аффинитетом могут вытеснять вещества с меньшим аффинитетом из соединения с рецепторами. Для определения равновесного состояния между «оккупированными» рецепторами (DR), свободными рецепторами и свободным веществом (D) используется константа диссоциации (KD), которую определяют по следующей формуле:
KD=[D]*[R]/[ DR]
Отрицательный логарифм KD (pRD) является показателем аффинитета. Для характеристики аффинитета часто используют показатель pD2, T. to je. отрицательный логарифм EC50, (концентрации вещества, в которой оно вызывает эффект, komponent 50% от максимального эффекта).
Разнообразие химических связей взаимодействия и их неодинаковая прочность, или аффинитет между лигандами и биорецепторами объясняется сложной структурой лекарственных веществ, содержащих различные по реакционной способности радикалы и имеющих многомерную объемную форму, а также сложностью процессов взаимодействия, протекающих зачастую в несколько этапов (fázy): образование комплекса лекарственное вещество — рецептор; внутримолекулярная группировка; диссоциация комплекса.
Tak, фармакологический эффект могут вызывать только вещества с выраженным сродством к биорецептору. Выраженность эффекта зависит от концентрации лекарственного вещества и общего числа рецепторов.
Если вещества обладают достаточной внутренней активностью, то их называют агонистами. Под внутренней активностью понимают способность агонистов вызвать биологический эффект путем изменения конформации рецепторов, T. to je. способность лиганда активировать рецептор. Это явление рассматривается как сродство комплекса агонист—рецептор к транедуктору, превращение внешних сигналов во внутренние получило название транедукции. Внутриклеточная передача сигнала лежит в основе таких процессов, как сокращение мышечных волокон, клеточное деление, šírenie, дифференциация и др. To je teraz stanovená, что ко многим веществам (гормонам, биоактивным пептидам, нуклеотидам, стероидам, низкомолекулярным биорегуляторам и др.) клетка имеет специфичные рецепторы. В результате взаимодействия указанных веществ с этими специфичными рецепторами образуются вторичные мессенджеры (посредники), которые запускают каскад биохимических реакций.
Существует понятие «частичные агонисты» — лекарственные вещества, že, связываясь с рецепторами, не дают максимального эффекта. Это непонятное явление предположительно объясняется неполной (menšie) зависимостью сродства комплекса лекарственное вещество — рецептор к транедуктору. Napríklad, частичный агонист опиатных рецепторов налорфин действует аналогично полному агонисту этих рецепторов морфину, хотя и слабее последнего. В то же время при совместном их применении налорфин ослабляет или устраняет эффекты морфина; najmä, устраняется угнетающее действие морфина на дыхание. Изопреналин — это истинный агонист, а преналтерол — частичный агонист для β-адренергических рецепторов. Согласно рецепторной теории, истинный агонист может индуцировать максимальный ответ, даже если он взаимодействует лишь с частью рецепторов.
Специфические рецепторы могут иметь одни и те же или разные места связывания для агонистов и антагонистов. Возможны разные места связывания для разных агонистов. V tom prípade, когда агонист и антагонист имеют одни и те же места связывания и блокирующее действие антагониста на рецептор полностью устраняется при повышении концентрации агониста (достигается максимальный эффект агониста), отношения между антагонистом и агонистом обозначают как конкурентный антагонизм. Если места связывания для агониста и антагониста различны, то отношения между ними определяют как неконкурентный антагонизм. Для характеристики антагонистов часто используют показатель pA2 (отрицательный логарифм молярной концентрации антагониста, при которой для получения стандартного эффекта агониста его концентрацию надо увеличить вдвое).
В условиях целого организма агонисты и антагонисты вызывают изменения тех или иных физиологических функций. Действие антагонистов при этом определяется тем, что они препятствуют влиянию на специфические рецепторы соответствующих естественных лигандов (napr, антагонист M-холинорецепторов атропин препятствует действию их агониста ацетилхолина). Zmeny, которые непосредственно связаны с взаимодействием веществ со специфическими рецепторами, обозначают термином «первичная фармакологическая реакция, которая может быть началом целой серии реакций, приводящих к стимуляции или угнетению определенных физиологических функций».
Изменения функций органов или систем (napr, изменения силы и частоты сердечных сокращений, тонуса гладких мышц внутренних органов, секреции желез, BP a ďalšie.), вызываемые лекарственным веществом, обозначают как фармакологические эффекты данного вещества. Tak, для сердечных гликозидов первичной фармакологической реакцией является угнетение активности транспортной Na+, К-АТФ-азы волокон миокарда, которая расценивается в качестве возможного специфического рецептора для сердечных гликозидов. В связи с этим нарушается поступление K+ в мышечные волокна и выход из волокон Na+, увеличивается содержание Ca2+ в цитоплазме, что способствует взаимодействию актина и миозина. Результатом указанных изменений является увеличение силы сердечных сокращений, что является основным фармакологическим эффектом сердечных гликозидов.
Продолжительное воздействие агонистов на специфические рецепторы нередко сопровождается снижением их чувствительности. Последняя может быть связана с изменением рецепторов, уменьшением их количества (плотности) или нарушением процессов, которые следуют за возбуждением рецепторов. При этом фармакологические эффекты агонистов становятся менее выраженными.
Tak, фармакологические эффекты большинства лекарственных веществ связаны с их воздействием на соответствующие специфические рецепторы.
Вещества с высоким сродством к биорецептору и низкой внутренней активностью называют антагонистами, или блокаторами, так как они, не вызывая изменений конформации биорецептора, препятствуют взаимодействию с ним эндогенных и/или экзогенных лигандов-агонистов. Существуют и так называемые «вторичные или немые рецепторы, с которыми лекарственные вещества связываются, но фармакологического действия не оказывают. Такие «немые» рецепторы наиболее часто присутствуют в белках и плазме крови (но могут находиться и в тканях). Соединение с «немыми» рецепторами приводит к снижению концентрации свободного лекарственного вещества, а значит и к снижению лечебного эффекта.
Многочисленные современные теории, объясняющие механизм взаимодействия лиганд—рецептор, состояние самих рецепторов, отсутствие пропорциональности между числом занятых рецепторов и конечной реакцией, изменение эффективности передачи сигнала и существование резервных рецепторов и частичных агонистов и т. d. легли в основу представлений о механизме действия представителей различных групп лекарственных веществ. Эти взаимодействия подразделяются на взаимодействие с рецепторами и химическое взаимодействие.
Механизм взаимодействия лекарственных веществ с биорецептором можно изобразить в виде следующей схемы: каждый лиганд (лекарственное вещество или физиологический субстрат) связывается со специфическим участком на определенном рецепторе. Активизированные рецепторы прямо или опосредованно регулируют потоки ионов (1) и/или другие внутриклеточные процессы (секрецию или мышечное сокращение) или активирует систему гуаниннуклеотидсвязывающих белков (G-белков), čo, podľa poradia, усиливает активацию системы второго посредника-фермента. В цитоплазме функционируют несколько разных вторых посредников, активизирующих различные белки-мишени, например протеин- киназы. Последние действуют на специфические субстраты и опосредуют фармакологический эффект.
Из представленного описания видно, что действие лекарственных веществ осуществляется по следующим механизмам:
- физиологические функции ткани (napr, сократительная, секреторная) могут регулироваться несколькими рецепторами, a teda, и различными лигандами;
- между взаимодействием лекарственного вещества с рецептором и ответом ткани или органа может существовать несколько промежуточных этапов, в частности активация связанных с рецепторами систем вторых посредников;
- эффективность механизмов, отвечающих за последовательность стимул—реакция, а также плотность рецепторов могут изменяться от ткани к ткани.
Терапевтический эффект некоторых лекарственных веществ обусловлен их прямым (не связанным со специфическими рецепторами) химическим взаимодействием с эндогенными соединениями или другими механизмами взаимодействия (Osmotický tlak, adsorpcie). Так для осмотических диуретиков — маннитола, мочевины — не существует специфических рецепторов. Эти вещества повышают осмотическое давление в почечных канальцах, вследствие чего нарушается реабсорбция воды и увеличивается диурез. Со специфическими рецепторами не связано действие адсорбирующих веществ, кислотообразующих диуретиков.
Antacidá (napr, алюминия или магния гидроксиды) реагируют с соляной кислотой с образованием продуктов со слабовыраженными кислотными свойствами. Хелатирующие агенты, связываясь с некоторыми металлами, образуют неактивные химические комплексы.
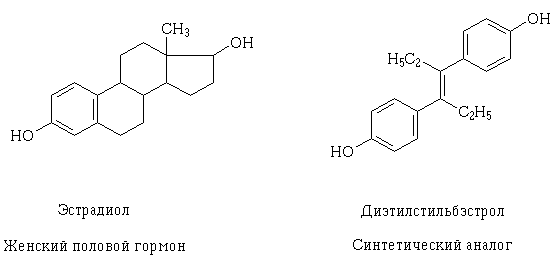
По мере углубления знаний о структуре рецепторов и механизме возможного фармакодинамического взаимодействия лекарств на клеточном уровне стало возможным целенаправленное их создание, а также объяснение, почему подобным действием могут обладать лекарственные вещества, отличающиеся, на первый взгляд, своей структурой. Примером такого явления могут служить эстрадиол и трансизомер диэтилстильбэстрола — синтетический аналог женского полового. Их структурные молекулы разные, но содержат одинаковые по свойствам и размерам функциональные оксигруппы, сходно расположенные и ориентированные в пространстве, благодаря чему молекулы этих веществ могут взаимодействовать с одним и тем же рецептором и оказывать сходное фармакологическое действие.
Способы, которыми лекарственные вещества вызывают те или иные фармакологические эффекты, обозначают термином «механизмы действия». Это понятие используют для объяснения действия лекарственных веществ на молекулярном, органном и системном уровнях. Napríklad, механизм действия антихолинэстеразных средств на молекулярном уровне сводится к блокаде ацетилхолинэстеразы путем взаимодействия с ее анионным и эстеразным центрами. V rovnakom čase, объясняя механизм гипотензивного действия антихолинэстеразных средств, указывают в качестве причины этого эффекта брадикардию и расширение сосудов, T. to je. рассматривают механизм данного эффекта на органном уровне.
Исследования механизмов действия лекарственных веществ ведутся постоянно, причем представления о механизме действия того или иного лекарственного вещества по мере получения новых данных могут не только становиться более детальными, но и существенно изменяться.
