Фармакокинетические взаимодействия и общие понятия о биодоступности и эквивалентности лекарственных препаратов
Разрабатывая общие подходы использования в фармакотерапии конкретных лекарственных препаратов, Anda mesti mengambil kira, что различные виды лекарственных форм имеют различную биодоступность. Если всасывание лекарственного вещества зависит в основном от его физико-химических свойств, то биодоступность — в значительной степени от свойств лекарственной формы. В связи с этим важное клиническое значение приобретает понятие эквивалентности и биодоступности лекарственных препаратов.
Фармацевтическая (химическая) эквивалентность лекарственных препаратов cara, что они содержат одинаковое количество данного активного вещества и соответствуют действующим стандартам, тогда как их неактивные компоненты могут различаться.
Понятие биоэквивалентности относится к химически эквивалентным препаратам, при введении которых одному пациенту в одинаковых дозах и по одинаковой схеме в крови и тканях накапливается активное соединение в одинаковых концентрациях.
Понятие терапевтической эквивалентности относится к лекарственным препаратам, которые при введении одному пациенту в равных дозах и по одинаковой схеме обнаруживают практически одинаковую терапевтическую эффективность или токсичность; при этом данные препараты могут быть небиоэквивалентными.
Представление об эффективности лекарственного препарата всегда связывают с его биодоступностью. Количественной характеристикой, определяющей биодоступность лекарственных препаратов (по определению FDA), является скорость и степень накопления лекарственных веществ в месте их предполагаемого действия. Однако получить образцы тканей и исследовать их на содержание лекарственных веществ в эксперименте невозможно. Поэтому о биодоступности лекарственной субстанции судят по ее концентрации в крови. На практике определяют абсолютную и относительную биодоступности.
Абсолютной биологической доступностью является отношение (dalam %) количества всосавшегося лекарственного вещества, введенного в виде пероральной или другой лекарственной формы, к количеству всосавшегося
того же вещества, в той же дозе, но в виде внутривенной инфузии или инъекции, обеспечивающих 100% bioavailabiliti.
Относительная биодоступность лекарственного вещества может быть измерена путем сравнения площадей под фармакокинетическими кривыми, характеризующими концентрацию вещества в сыворотке крови обоих лекарственных препаратов при тождественном способе их введения, например пероральном или ректальном. Биодоступность оценивается по концентрации лекарственного вещества в крови или в моче, если вещество выделяется из организма в неизмененном состоянии.
Если лекарственные препараты имеют одинаковую биодоступность в тождественных условиях, их считают биоэквивалентными.
По мнению FDA, препараты могут быть биоэквивалентными, несмотря на различия в скорости и степени всасывания (когда скорость всасывания не является решающей характеристикой для достижения эффективной концентрации активного вещества в организме или является несущественной для проявления терапевтического эффекта препарата). В отдельных случаях скорость всасывания действующего вещества из лекарственных препаратов может влиять на эффективность лечения. Satu pihak, при медленном всасывании концентрация вещества в крови может быть ниже минимальной терапевтической, что не обеспечивает желаемого лечебного эффекта, а с другой — при слишком быстром всасывании она может сильно превышать порог допустимой концентрации, что вызывает нежелательные побочные эффекты, или оказывается токсичной. Поэтому лекарственные препараты, характеризующиеся незначительной разницей между минимально эффективной и максимально переносимой дозами вещества, будут биоэквивалентными в том случае, если и степень, и скорость их всасывания будут одинаковыми.
Проблема биодоступности приобретает особую остроту, когда лекарственные препараты предназначены для приема внутрь. С позиции клинической фармации важное значение имеет различие биодоступности одного вещества из различных видов лекарственных форм. Ее определение затрудняется в невозможности учета всех индивидуальных особенностей пациента и различных свойств лекарственных форм. При пероральном приеме препаратов лекарственное вещество, прежде чем попасть в системный кровоток, претерпевает целый ряд превращений и достигает места назначения в меньшем количестве, что и обуславливает низкую его биодоступность (sebagai contoh, norapinefrin, testosteron, фенацетин и др.). Причинами низкой биодоступности вещества могут быть недостаточное время его пребывания в ЖКТ, а также возрастные, половые и генетически обусловленные различия, разная активность пациента, наличие стрессовых ситуаций, наличие тех или иных болезней и т. d. Биодоступность вещества уменьшается и под действием многочисленных факторов, влияющих на его всасывание.
Особые проблемы возникают при продолжительной терапии, когда больного, адаптировавшегося к одному виду лекарственной формы, переводят на другую, неэквивалентную. В этом случае может снизиться уровень эффективности терапии, возникнуть токсические эффекты. Такие случаи известны при замене лекарственных препаратов дигоксина, фенитоина и др.
Иногда удается достичь терапевтической эквивалентности лекарственных препаратов, несмотря на различия их биодоступности. Sebagai contoh, различие между терапевтической и токсической концентрациями бензилпенициллина велико, поэтому колебания его концентрации в крови, обусловленные разной биодоступностью лекарственных препаратов, могут существенно не сказываться на их терапевтической эффективности или безопасности. Opposite, для лекарственных препаратов с относительно небольшим различием между терапевтической и токсической концентрациями разница в биодоступности имеет большое значение.
Поскольку терапевтический эффект, его продолжительность и выраженность обуславливается временной зависимостью концентрации лекарственного вещества в плазме крови, обычно учитывают три параметра — максимальную концентрацию вещества в крови, время ее достижения и площадь под кривой, полученной в координатах концентрация—время.
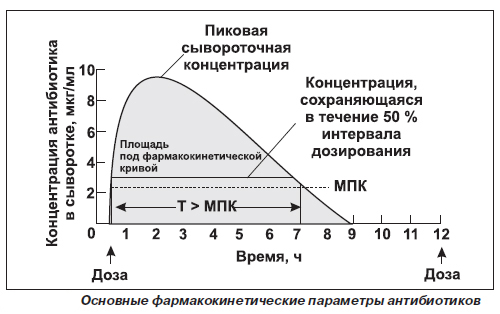
Из рисунка видно, что концентрация вещества в крови возрастает с увеличением скорости и степени его всасывания и достигает максимума, когда скорость выделения вещества из организма становится равной скорости всасывания. Чем медленнее происходит всасывание вещества, тем позже достигается его максимальная концентрация.
Однако оценка биодоступности с учетом данных о максимальной концентрации лекарственного вещества в крови может оказаться недостаточно точной, поскольку с поступлением вещества в системный кровоток начинается его элиминация. Время достижения максимальной концентрации зависит от скорости всасывания вещества и служит показателем этой скорости. Наиболее важным показателем биодоступности является площадь под кривой зависимости концентрации (ПКК) от времени. Она прямо пропорциональна общему содержанию неизмененного вещества в плазме крови. Для определения ПКК осуществляют забор крови до полной элиминации вещества. Два лекарственных препарата, имеющие идентичные кривые скорости и степени абсорбции можно считать биоэквивалентными. Если препараты имеют одинаковые ПКК, но различаются по форме кривых зависимости концентрации от времени, их считают эквивалентными по степени абсорбции, но различающимися по ее скорости.
Определение биодоступности при многократном введении лекарственного препарата предпочтительнее. ПКК измеряют в один из промежутков между двумя последовательными введениями. Более точные усредненные результаты получаются при определении биодоступности в течение суток. Если лекарственное вещество экскретируется с мочой (в основном в неизмененном виде), то его биодоступность можно оценить, определив общее количество в течение времени, равного 7-10 периодам полужизни вещества. Более точное определение биодоступности возможно при исследовании крови и мочи одновременно.
Oleh itu, биодоступность и биоэквивалентность являются важнейшими показателями качества лекарственных препаратов при характеристике их терапевтических возможностей.
