Коагуляционный гемостаз – Järjestelmä hemostaasin
Свертывание крови — сложный ферментный процесс, в котором участвует ряд протеолитических ферментов, а также неферментные белковые и фосфолипидные компоненты, резко ускоряющие и усиливающие активацию и действие ферментов.
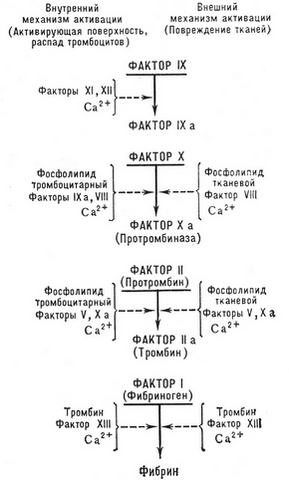
Условно процесс свертывания крови может быть разделен на две основные фазы:
- начальную многоступенчатую, приводящую к активации протромбина (фактора II) с превращением его в активный фермент — тромбин (II a);
- конечную, в которой фибриноген под влиянием тромбина превращается вначале в мономеры и димеры фибрина, а затем — в фибрин-полимер, который стабилизируется активированным фактором XIII.
По международной номенклатуре, все факторы свертывания, Lisäksi – тромбоцитарных, обозначаются римскими цифрами (taulukossa).
Характеристика факторов свертывания крови | |||||
Цифровое обозначение | Наиболее принятые наименования | Содержание в плазме крови, g / l | Активность, % | Период полужизни в плазме крови после внутривенного введения | Минимальный уровень, необходимый для гемостаза |
| Minä | Фибриноген | 1.8-4,0 | – | 3—5 дней | 0,8 g / l |
| II | Протромбин | To 0,1 | 80—120 | 3—4 дня | 40% |
| III | Тканевый тромбопластин | 0 | 0 | ? | – |
| IV | Kalsiumionit | 0,9—1,2 ммоль/л | – | – | – |
| V | Ac-глобулин (проакцелерин) | To 0,01 | 70—150 | 18—24 ч | 10-15% |
| VII | Проконвертин | " 0,005 | 80—120 | 4—6 ч | 5-10% |
| VIII | Антигемофильный глобулин (АГГ)
| 0,01—0,02 | 60—250 | 12—18 ч | 30—35% |
| IX | PTC-фактор (Plasma Thromboplastin component), кристмас-фактор | To 0,003 | 70—130 | 20—30 ч | 20—30% |
| X | Фактор Стюарта—Прауэра | " 0,01 | 80—120 | 48—56 ч | 10—20% |
| XI | PTA-фактор (Plasma Thromboplastin antecedent), плазменный предшественник тромбопластина | " 0,005 | 70—130 | 60 ei | ? |
| XII | Фактор Хагемана, контактный фактор | To 0,03 | 70—150 | 2- 3 päivää | vähemmän 1 % |
| XIII | Фибринстабилизирующий фактор (фибриназа) | 0,01-0,02 | 70—130 | 2- 3 päivää | 2-5% |
| Plasman prekallikreiini, фактор Флетчера | To 0,05 | 60—150 | ? | vähemmän 1 % | |
| Высокомолекулярный кининоген (ВМК), фактор Фитцжеральда, фактор Флоджека, фактор Вильямса | To 0,06 | 80—130 | ? | vähemmän 1 % | |
Для обозначения того, что эти факторы подверглись активации к, цифровым символам фактора добавляется буква «a», а в том случае; если активным действующим началом фактора становится один из его фрагментов,— буква «f»
Помимо цифрового обозначения используются и другие наименования факторов свертывания — по их функции (esimerkiksi, фактор VIII — антигемофильный глобулин), по фамилиям больных с впервые: обнаруженным дефицитом того или иного фактора (фактор XII — фактор Хагемана, фактор X — фактор Стюарта—Прауэра ja jne.), реже — по фамилиям авторов (esimerkiksi, von Willebrand -tekijän).
Свертыванию крови противодействуют ensisijainen (самостоятельно синтезируемые) и вторичные, образующиеся в процессе свертывания и фибринолиза физиологические антикоагулянты.
Трансформация фибриногена в фибрин
Рассмотрение процесса свертывания крови целесообразно начать с его конечного этапа, заключающегося в том, что протеолитический фермент тромбин, образующийся из своего неактивного предшественника — protrombiinia, отщепляет от молекулы фибриногена четыре пептида (два пептида A и два пептида B), в результате чего образуются мономеры фибрина у каждого из которых имеется четыре свободных связи. Путем соединения этими связями мономеров друг с другом сначала парами — в димеры, а затем — в полимеры (соединения по типу «конец в конец» и «бок в бок»). формируются волокна фибрина.
Фибриноген — глобулярный гликопротеин (moolimassa 340000), состоящий из двух одинаковых субъединиц. Каждая из субъединиц состоит из трех цепей — Aα, Bβ и γ.
Вначале тромбин отщепляет от этой молекулы пептиды A (образуя дес-A-мономеры фибрина), затем — пептиды B (дес-AB или полные мономеры фибрина). Появление свободных пептидов A в циркулирующей крови (определяются иммунологически с помощью анти-A-сыворотки) служит признаком тромбинемии и используется в качестве «свидетеля» внутрисосудистого свертывания крови (DVS sindrome kanssa, массивных тромбозах).
Мономеры фибрина имеют трехнодулярную структуру, и их соединение в полимер проходит этапы формирования димеров, из которых при продольном и поперечном связывании образуются протофибриллы, а затем — волокна фибрина. Этот фибрин растворим в 5—7 М . мочевине или в 2 % монохлоруксусной кислоте, в связи с чем он обозначается как фибрин S (solubile). Под влиянием фактора XIII, который также активируется тромбином в присутствии ионов кальция, в фибрине образуются дополнительные дисульфидные связи как между γ-, так и α-цепями, что делает его. нерастворимым в мочевине— фибрин I (insolubile).
В нормальных условиях уже сравнительно умеренные концентрации тромбина (esimerkiksi, вызывающие свертывание плазмы крови за 10—12 с) обеспечивают полную трансформацию фибриногена в фибрин, в силу чего в сыворотке крови этот белок иммунологическими и другими методами уже не определяется.
Sitä vastoin,, при процессах, характеризующихся внутрисосудистым свертыванием крови, снижается чувствительность к тромбину и в той или иной степени нарушается процесс полимеризации мономеров фибрина, в силу чего тромбиновое время свертывания удлиняется и указанные выше пороговые дозы тромбина коагулируют уже не весь фибриноген. Нарушение это связано с тем, что часть полных и неполных мономеров фибрина образуют комплексные соединения с фибриногеном и, luultavasti, с ранними продуктами расщепления фибрина и фибриногена плазмином. Эти крупномолекулярные и среднемолекулярные растворимые фибрин-мономерные комплексы (RFMK), обозначаемые в литературе так же как «плохо свертывающийся фибрин», «заблокированный фибриноген», плохо коагулируют под влиянием тромбина (обладают относительной тромбин-резистентностью), но образуют гель при добавлении к плазме 50 % etanoli (этаноловый тест), некоторых образцов протамин-сульфата, раствора β-нафтола в 50 % alkoholi, кислого ортофенантролина.
Феномен неферментной коагуляции РФМК (заблокированного фибриногена) Sitä kutsutaan феномен паракоагуляции и широко используется в лабораторной диагностике тромбинемии и внутрисосудистого свертывания крови. Наиболее полно выявить эти комплексы позволяют следующие тесты:
- коагуляционная проба с ядом среднеазиатской змеи эфы;
- проба с ортофенантролином;
- Testi tarttumista stafylokokki.
Täten, трансформация фибриногена в фибрин может идти как обычным путем, так и с образованием РФМК (продуктов паракоагуляции), выявление которых имеет важное значение для диагностики внутрисосудистого свертывания крови.
Общая оценка конечного этапа процесса свертывания проводится с помощью тромбинового теста, t. se on. путем определения времени свертывания цитратной плазмы при добавлении к ней стандартного количества тромбина. Тест имеет большое значение для диагностики многих нарушений свертываемости крови, его результаты важны для правильного толкования показаний всех других коагуляционных проб, ибо торможение конечного этапа процесса удлиняет время свертывания во всех остальных исследованиях.
Механизмы трансформации протромбина в тромбин
Согласно современной каскадно-комплексной теории свертывания крови, активация протромбина (фактора II) является результатом многоступенчатого ферментного процесса, в котором последовательно активируются и взаимодействуют между собой различные факторы свертывания. Из них факторы III, VII, X, IX, XII и XI, а также прекалликреин являются протеолитическими ферментами, а факторы VIII, V — неферментными акцелераторами процесса, ускоряющими активацию ферментных факторов во много тысяч раз.
Различают два основных механизма запуска процесса свертывания – внешний и внутренний.
Внешний механизм свертывания крови
Внешний механизм свертывания крови запускается тканевым тромбопластином, который может попадать в плазму крови из поврежденных (vamma, операции и др.) kudokset, стенок сосудов (вырабатывается поврежденным эндотелием при участии активированных тромбоцитов), а также поступать в кровоток с тканевой жидкостью (lapsivesi embolia, перитонеально-венозное шунтирование, различные виды шока). Непосредственно в крови тканевый тромбопластин может продуцироваться активированными моноцитами (под влиянием эндотоксина, иммунных комплексов и т. d.).
В большом количестве тканевый тромбопластин вырабатывается и клетками некоторых злокачественных опухолей (в том числе лейкозными).
Действующим началом тканевого тромбопластина является белок — апопротеин C, тогда как фосфолипидная часть фактора III неспецифична и выполняет роль активирующей процесс матрицы (t. se on. функционально сходна с фактором 3 Verihiutale, кефалином, эритрофосфатидом).
Из схемы свертывания крови видно, что тканевый тромбопластин образует комплекс с ионами кальция и фактором VII, активирует последний, в результате чего образуется мощный ферментный активатор фактора X.
В лабораторных условиях внешний механизм имитируется тестом протромбинового времени, при выполнении которого к рекальцифицированной цитратной плазме добавляется извне тканевый (чаще всего из мозга человека или кролика) тромбопластин определенной активности и регистрируется время свертывания.
Внутренний механизм свертывания крови
Внутренний механизм значительно более сложен и важен для расшифровки патогенеза и диагностики наиболее часто встречающихся в клинической практике геморрагических диатезов — гемофилий A и B, ангиогемофилии, или болезни Виллебранда (на их долю приходится более 97 % всех наследственных геморрагических коагулопатий).
При внутреннем механизме свертывание крови (plasma) реализуется без участия тканевого тромбопластина.
Пусковым фактором этого механизма является фактор XII (Хагемана), активация которого происходит вследствие контакта крови либо с чужеродной поверхностью (стеклом, металлом, каолином и т. d.), либо с субэндотелием (коллагеном) и другими компонентами соединительной ткани, что наблюдается при повреждении стенок кровеносных сосудов (механических травмах, васкулитах, атеросклерозе и т. d.).
Lisäksi, активация фактора XII может осуществляться путем его ферментативного расщепления (калликреином, плазмином или другими протеазами). Siten, возможны два вида активации фактора XII:
- ja) контактный — с образованием фактора ХIIа;
- että) ферментный — с образованием активного фрагмента фактора XII (ХIII).
Имеются определенные качественные различия между действием факторов XIIa (в большей степени влияет на свертывание) и XIII (оказывает большее активирующее влияние на калликреин-кининовую систему и фибринолиз). В целом же фактор XII является универсальным активатором всех плазменных протеолитических систем — свертывающей, калликреин-кининовой, фибринолитической и системы комплемента.
В начальной (контактной) фазе процесса свертывания происходит, toinen puoli, взаимная активация фактора XIIa и калликреина в комплексе фактор XII — прекалликреин — высокомолекулярный кининоген, а затем — активация фактора XI в комплексе факторов XIIa — XI — ВМК.
Этот начальный этап наиболее длительный (4/5 kaikki hyytymisaikaan), активируется с нарастанием площади и продолжительности контакта крови с чужеродной поверхностью (минимальна активация при силиконировании посуды и более быстром проведении исследования после взятия крови из вены, максимальна — при добавлении каолина). Важно учитывать, что контактная активация факторов XII и XI происходит в стабилизированной цитратом или оксалатом крови и плазме, t. se on. не нуждается в ионах кальция. Участие кальция в свертывании крови начинается лишь с момента активации фактора IX, t. se on. образования следующего комплекса 2.
При создании максимального контакта каолином и достаточном количестве фактора 3 тромбоцитов или кефалина (t. se on. в активированном парциальном тромбопластиновом тесте) ослабление активации фактора XI и замедление свертывания может быть вызвано дефицитом факторов XII, XI. prekallikreina, suuri moolimassa kininogeeniä (ВМК). Чаще всего встречается дефицит фактора XI, остальные нарушения наблюдаются крайне редко.
Значительно чаще нарушение внутреннего механизма свертывания связано с дефектом следующего этапа — активации факторов IX и VIII. Yleensä, это связано с дефицитом компонентов фактора VIII, t. se on. с гемофилией A и ангиогемофилией или болезнью Виллебранда (noin 93 % всех больных), реже — с дефицитом фактора IX (гемофилией B).
Большое значение для клиники фактора VIII требует более детального рассмотрения данных о его структуре и функции.
Согласно современным данным, фактор VIII является белковым полимером, состоящим из ряда одинаковых субъединиц. В каждой из субъединиц имеются следующие компоненты:
1) коагуляционная часть (VIII: FROM) и ее антиген (VIII: САг);
2) von Willebrand -tekijän (FV) или кофактор ристомициновой агрегации тромбоцитов (VIII: FV, VIII: Pkof) и его антиген (VIII: RÄTTI, VIII: РАг /ФВ);
3) углеводная часть и, ehkä, еще один неидентифицированный белковый компонент.
Место синтеза VIII:FROM ei ole tarkkaan vahvistettu, контролируется этот синтез геном, находящимся в Х-хромосоме; изолированное нарушение его характерно для гемофилии А.
Синтез фактора Виллебранда (FV) контролируется аутосомно и происходит практически только в эндотелии, вследствие чего этот фактор используется в качестве маркера эндотелия; его уровень в крови резко повышается при многих сосудистых заболеваниях.
Дефицит фактора Виллебранда или изменение его мультимерной структуры вызывает как нарушение сосудисто-тромбоцитарного гемостаза (pitkittynyt verenvuoto, нарушение адгезии тромбоцитов к стеклу и коллагену или ристомицин-агрегации тромбоцитов), так и снижение коагуляционной активности VIII:FROM. Эти нарушения в разных сочетаниях наблюдаются при различных вариантах ангиогемофилии. В крови ФВ содержится как в плазме, так и в тромбоцитах (в α-гранулах), причем внутри этих клеток он разобщен с VIII:FROM. При гемофилии A уровень VIII:С резко снижен, тогда как содержание в плазме VIII:ФВ остается нормальным.
Фактор VIII:FROM — неферментный акцелератор фактора IXa, с которым он образует комплекс на фосфолипидной матрице. Активируется VIII:С по принципу обратной связи малыми дозами тромбина (II a) ja, ehkä, фактором Xa; при этом он диссоциирует с ФВ. Вслед за активацией тромбин расщепляет и инактивирует фактор VIII:С как прямо, так и косвенно путем активации протеина С.
Взаимодействие внешнего и внутреннего механизма свертывания крови
В организме внешний и внутренний механизмы активации свертывающей системы крови не разобщены, а интимно взаимодействуют друг с другом. Niin, факторы XII + калликреин активируют фактор VII. Существенную роль играют также взаимная активация факторов VIIa и IXa, а также VIIa и Xa.
Фактор VIIa частично активируется также плазменными липопротеинами и триглицеридами, а ретроградно тромбином. В силу этого выявление активации и повышения уровня фактора VIIa служит глобальным маркером внутрисосудистой активации системы свертывания крови и высокого тромбогенного риска, особенно при ишемической болезни сердца и гиперлипидемиях.
Как при внешнем, так и при внутреннем механизмах свертывания взаимодействие и активация факторов осуществляются на фосфолипидных микромембранах, служащих матрицами, на которых фиксируются (с помощью ионов кальция), меняют свою четвертичную и третичную структуру, интенсивно реагируют друг с другом белковые факторы. Роль таких матриц выполняют мембраны оболочек и гранул тромбоцитов (tekijä 3 Verihiutale) и сходные с ними компоненты из оболочек других клеток (эритроцитов и пр.). В значительной степени наличие этих фосфолипидных мембранных матриц определяет то, что при прочих равных условиях период свертывания плазмы, содержащей небольшое количество тромбоцитов, более продолжительный, чем время свертывания плазмы с нормальным количеством тромбоцитов, ja sitten, mitä gemoliz (освобождение эритроцитарных мембран) очень ускоряет свертывание и искажает показания коагуляционных тестов (делает гемолизированную кровь непригодной для исследования свертывающей системы крови).
В силу неодинаковых условий фосфолипидной активации показания нестандартизированных коагуляционных тестов подвержены очень большим случайным колебаниям. Этот разброс еще более возрастает из-за неодинаковой по интенсивности (свойства стекла пробирок) и продолжительности контактной активации фактора XII. Стандартизация коагуляционных тестов по контакту (получение и обработки крови в условиях силиконирования лабораторной посуды или во фторопластовых пробирках с последующей максимальной активацией контактной фазы каолином) и по фосфолипидной активации (добавление стандартных количеств кефалина) делает их намного более точными и воспроизводимыми.
To оценки свертывающей активности тромбоцитов следует сравнивать каолиновое время свертывания плазмы с высоким и низким содержанием тромбоцитов (исключив из реакции кефалин).
Täten, полная оценка процесса свертывания при запуске его по внутреннему механизму осуществляется с помощью исследования общего времени свертывания крови стандартизированными тестами — каолиновым и каолин-кефалиновым (активированное парциальное тромбопластиновое время), а также двухступенчатым аутокоагуляционным тестом.
Аналогичным образом активируется и инактивируется другой неферментный акселератор свертывания — фактор V, взаимодействующий с фактором X. Этот комплекс именуется в литературе протромбиназой (по устаревшей терминологии — кровяной тромбопластин), в которой активной ферментной частью является фактор Xa, трансформирующий протромбин в тромбин. На фосфолипидной матрице (esimerkiksi, на мембране тромбоцита) активность этого комплекса в 1000 kertaa suurempi, чем при отсутствии фосфолипида. Комплекс же Va—Xa в 3000 kertaa enemmän, чем фактор Xa. Täten, фактор Va и фосфолипидная матрица в совокупности повышают активность протромбин азы по сравнению с изолированным фактором Xa в 300000 aika.
На поверхности каждого тромбоцита имеется около 3000 фосфолипидных рецепторов к комплексу Va—Xa, из них около 1000 рецепторов высокоаффинных. Матрицами для всех комплексов факторов свертывания могут служить фосфолипидные микромембраны кефалина и оболочек эритроцитов (эритроцитин, эритрофосфатид), что широко используется в лабораторной практике.
При активации фактором Xa протромбин превращается в активный α-тромбин. При этом от него последовательно отщепляется фрагмент 1 и остается претромбин 1, а затем — фрагмент 2 и остается претромбин 2. При таком расщеплении одноцепочная молекула протромбина трансформируется в двухцепочную (цепи A и B) молекулу α-тромбина. Затем последний подвергается аутолизу и утрачивает активность, а также инактивируется физиологическими антитромбинами.
Под влиянием других эндо- и экзогенных (яды змей и пр.) протеолитических ферментов могут образовываться формы тромбина, отличающиеся от α-тромбина более слабой коагулянтной активностью, меньшей чувствительностью к комплексу гепарин — антитромбин III и другими свойствами.
Ионизированный кальций необходим для свертывания крови, поскольку он участвует в следующих процессах:
- молекулярной конформации факторов свертывания в активную форму;
- фиксации взаимодействующих факторов на фосфолипидных матрицах;
- ускорении активации отдельных факторов путем присоединения к ним (esimerkiksi, трансформация протромбина в тромбин ускоряет Ca++ в 1000 раз путем присоединения его к γ-карбоксиглютамиловым остаткам в NH2-терминальной части молекулы).
При анализе результатов основных коагуляционных тестов важно учитывать следующее:
- в используемых тест-системах VII фактор участвует только во внешнем механизме процесса, в силу чего при его дефиците удлиняется лишь про- тромбиновое время;
- факторы XII, XI, IX, VIII и прекалликреин участвуют во внутреннем механизме активации, в связи с чем при их дефиците нарушаются АПТВ и АКТ, тогда как протромбиновое время остается нормальным;
- при дефиците факторов X, V, II и I, на которых замыкаются оба механизма свертывания, патология выявляется во всех перечисленных выше тестах.
Вместе с тем внешний и внутренний механизмы активации не изолированы друг от друга, взаимодействуют между собой.
Niin, выявлена взаимная активация фактора VII и факторов IX и X, а также активация фактора VII комплексом XIIa—калликреин—ВМК. Включение этих «мостов» между внутренним и внешним механизмами служит одним из диагностических критериев предтромботического состояния или латентного внутрисосудистого свертывания крови. Выявляется это по повышению активности фактора VII в плазме крови при тестировании ее на плазме, лишенной этого фактора, а также с помощью теста холодовой активации протромбинового времени с бычьим тромбопластином.
Многие факторы свертывания и фибринолиза синтезируются в печени. Из них факторы II, VII, X и IX, а также антикоагулянты — протеины C и S K- витаминозависимы: конечный этап их синтеза (карбоксилирование) нарушается при дефиците филлохинонов (K-vitamiini) и под влиянием его антагонистов — кумаринов, фенилина и пр. При этом нарушается образование в гепатоцитах K-витаминозависимой карбоксилазы, что лишает факторы свертывания способности к активации. Описан наследственный геморрагический диатез, при котором вследствие нарушения синтеза этой карбоксилазы снижен уровень всех K-витаминозависимых факторов свертывания.
Sitä vastoin,, V фактор и ряд компонентов фибринолитической и калликреин-кининовой системы синтезируются в печени независимо от филлохинонов.
