Veren hyytymisjärjestelmän tutkimus
Menetelmät veren hyytymisjärjestelmän tutkimiseksi sisältävät seuraavat ryhmät:
- suuntaa-antava (yleistä), antaa käsityksen koko hyytymiskaskadin tilasta kokonaisuutena ja sen yksittäisistä vaiheista (rekisteröinti voidaan tehdä visuaalisesti tai käyttämällä erillisiä laitteita - koagulografia, tromboelastografi jne.);
- yksittäisten tekijöiden erottava puutos - korjaavat koagulaatiotestit, kokeet tutkitun veriplasman sekoittamiseksi sellaisten potilaiden veriplasmaan, joilla tiedetään olevan tiettyjen tekijöiden puutos;
- järjestelmän yksittäisten komponenttien määrällinen määrittäminen niiden toiminnallisen toiminnan perusteella (hyytymistestit, tutkimukset kromogeenisilla ja muilla substraateilla) ja (tai) immunologisten merkkiaineiden avulla;
- veren hyytymis- ja fibrinolyysiprosessin suonensisäisen aktivaation tunnistaminen toiminnallisten ominaisuuksien tai aktivoitumisen molekyylimarkkereiden perusteella - aktivoituneiden hyytymistekijöiden tunnistaminen verenkierrossa, verihiutaleiden degranulaatiotuotteet, veren hyytymisjärjestelmän komponenttien tai niiden metaboliittien hajoaminen, aktivoitujen tekijöiden ja niiden kompleksien uusien antigeenisten markkerien ilmaantuminen, veren hyytymisjärjestelmän leimattujen komponenttien nopeutunut aineenvaihdunta (vähentää niiden puoliintumisaikaa kierrossa).
Täten, arvioitaessa veren hyytymisjärjestelmän tilaa, niitä käytetään hyytymistekniikat (laboratorio ja instrumentaali), muodostavat perustan diagnostiselle prosessille, ja immunologinen, radionuklidi- ja muuntyyppiset tutkimukset. Lisäksi monissa tapauksissa järjestelmän komponentit voidaan määrittää sekä toiminnallisen toiminnan perusteella, ja immunologisesti - vastaavan antigeenin pitoisuuden mukaan veressä. Tällaisten tekniikoiden rinnakkainen käyttö mahdollistaa patologian muotojen erottamisen, liittyy vastaavan hyytymistekijän synteesin puutteeseen (tässä tapauksessa sen molempien toiminnallinen aktiivisuus vähenee yhtä paljon, ja antigeenin määrä), ja muotoja, jossa tekijämolekyyli syntetisoidaan, mutta hän on epänormaali ja toiminnallisesti viallinen.
Ensimmäiset lomakkeet osoittavat, että vastaavan tekijän numeroon lisätään merkki "—". (esimerkiksi, VIII-, IX- ja t. d.), ja toisessa - "+"-merkki (esimerkiksi, VIII+, IX+).
Lähentää (yleistä) koagulaatiotesteissä
Veren hyytymisajan määrittäminen
Veren hyytymisajan määrittäminen (parempi kuin Lee-White-tekniikka) - Pitkään käytetty, nopea toteuttaa (suoraan potilaan sängyn viereen) orientaatiotesti, mahdollistaa merkittävien verenvuotohäiriöiden havaitsemisen, liittyy hemokoagulaatiotekijöiden puutteeseen (paitsi tekijä VII) tai antikoagulanttien ja fibrinolyyttien vaikutuksesta. Käytetään indikatiivisena testinä ja hepariinihoidon seurantaan, eliminoi hepariinin vaikutuksen protamiinisulfaatilla. Testi on suhteellisen alhainen herkkyys, sen indikaattoreita rikotaan vain plasman hyytymistekijöiden pitoisuuden selvällä laskulla (alle 4-5 %), siksi ei sovellu hemofilian A ja B lievien muotojen havaitsemiseen, sekä veren hyytymishäiriöt angiohemofiliassa, tekijä XI:n puutos, prekallikreiini, ja korkea kininogeenistä. Näistä syistä testiä ei voida käyttää potilaiden preoperatiiviseen tutkimukseen.: normaaleilla testituloksilla (5-10 min) runsasta leikkauksen jälkeistä verenvuotoa voi esiintyä.
Plasman uudelleenkalkkiutumisaika
Plasman uudelleenkalkkiutumisaika - standardoimaton matalan herkkyyden testi, vähemmän luotettava hypokoagulaation havaitsemiseen, kuin kokoveren hyytymisaika. Ei voida suositella hemostaasihäiriöiden diagnosointiin.
Aktivoitu plasman osittainen tromboplastiiniaika
Aktivoitu plasman osittainen tromboplastiiniaika (APTV, kaoliini-kefaliini testi) - erittäin herkkä menetelmä, veren hyytymishäiriöiden havaitseminen, kun prosessi alkaa sisäisen mekanismin kautta. Selektiivisesti herkkä plasman hyytymistekijöiden puutteelle (verihiutaleiden ja tekijän puutteen vuoksi 3 verihiutaleet kompensoidaan ulkoisesti annettavalla kefaliinilla tai erytrofosfatidilla).
Käytetään hepariinihoidon seurantaan, potilaiden leikkausta edeltävä tutkimus jne.. d. Vakioindikaattorit riippuvat käytetyistä kefaliininäytteistä, useimmissa tapauksissa se on 37-50 s (optimaalinen - 37-45 s).
Kaoliini plasman aika
Plasman kaoliiniaikatesti, samanlainen kuin edellinen, mutta ilman kefaliinin lisäämistä plasmaan (erytrofosfatidi), seurauksena se on herkkä paitsi plasman hyytymistekijöiden puutteelle, mutta myös verihiutaleiden ja tekijän puutteesta 3 Verihiutale. Tämän tekijän aktiivisuuden likimääräinen arviointi voidaan suorittaa vertaamalla koehenkilön plasman kaoliiniaikaa korkeaan ja alhaiseen verihiutalepitoisuuteen (normaali - 57-70 s).
Fosfolipidikomponenttien käyttöä ei suositella, antamalla APTT:lle hyytymisaika, joka on yhtä suuri 55 s tai enemmän, koska tämä heikentää jyrkästi testien tarkkuutta ja toistettavuutta, mukaan lukien tekijöiden VIII ja IX kvantitatiivisessa määrittämisessä.
Silikoni Plasma Aika
Silikonin plasmaaika on plasman uudelleenkalkkiutumisaika, saatu silikonointineuloilla, koeputkia, pipetti, t. se on. minimaalisella kontaktin aktivoinnilla. Testi on herkkä hyperkoagulaatiolle – laukaisevan kontaktivaiheen suonensisäiselle aktivaatiolle (tekijät XII ja XI), kuitenkin tämä häiriö tunnistetaan selvemmin määrittämällä kokoveren silikonin hyytymisaika (perustuu Lee-White-menetelmään tai prosessin tromboelastografiseen tallentamiseen silikonoidussa kyvetissä).
Vakioindikaattorit riippuvat käytetystä silikonista ja ne määritetään testaamalla terveiden ihmisten veri jokaisesta näytteestä erikseen.. Kun valitset silikonia, paras on, mikä pidentää veren hyytymisaikaa eniten (plasma).
Protrombiini (tromboplastiini) plasman aika
Protrombiini (tromboplastiini) plasman aika (Kwikin aika, protrombiinia index) luonnehtii uudelleen kalkkeutuneen veriplasman hyytymisnopeutta, kun prosessi käynnistyy ulkoisella mekanismilla, t. se on. lisäämällä ihmisen aivojen tromboplastiinia (tai kani).
Tromboplastiinin aktiivisuus standardisoitu normaalin sekanäytteille (ohjata) plasma. Useimmiten käytetään tromboplastiineja, joiden aktiivisuus on 12-18 s. (klassisessa Quick-menetelmässä - 12-13 s). Mitä heikompi tromboplastiini, sitä suurempi menetelmävirhe.
Normaalilla plasman protrombiiniajalla testi mahdollistaa protrombiinikompleksitekijöiden yksittäisen tai kumulatiivisen puutteen tunnistamisen - VII, X, Va II, joista kolme tekijää (VII, X iloa) K-vitamiinit ovat riippuvaisia ja niiden aktiivisuus vähenee epäsuorien antikoagulanttien vaikutuksesta. Tässä suhteessa protrombiinitesti on tärkein kumariinien annostusta seurattaessa (neodikumariini, tai vaippa, sinkumar et ai.) ja muut tämän ryhmän lääkkeet (fenilin).
Protrombiiniaika pysyy normaalina, kun protrombinaasin aktivoitumisen sisäisen mekanismin tekijöitä puuttuu - tekijät XII, XI, IX, VIII (t. se on. kaikentyyppisiin hemofiliaan ja Hageman-defektiin), sekä prekallikreiinin ja korkean molekyylipainon kininogeenin puutos (VM kininogeeni)
Kirjallisuudessa hyväksytään monenlaisia asioita protrombiinitestin tulosten nimeäminen. On tarkoituksenmukaisinta ilmoittaa testin protrombiiniaika ja kontrolloida veriplasma sekunneissa (joka antaa myös tietoa käytetyn tromboplastiinin aktiivisuudesta). Joskus käytetään näiden kahden määrän suhdetta, t. se on. indeksi (Testiplasman PT, alkaen ,)/(Kontrolliplasman PT, alkaen), (normi 0,9-1,1).
Toinen tapa arvioida tätä indikaattoria, jota käytetään eniten laboratorioissa, on protrombiiniindeksin laskeminen prosentteina laskemalla käänteinen aritmeettinen suhde (normi - 90-110%), tämä laskelma on kuitenkin virheellinen, koska hyytymistekijöiden pitoisuuden ja hyytymisajan välillä on ei-aritmeettinen suhde, ja logaritminen riippuvuus. Lisäksi, protrombiinitesti on herkkä vain alla olevien hyytymistekijöiden laskulle 50 % niiden normaali koko. Tästä syystä on suositeltavaa käyttää protrombiiniindeksin määritystä prosentteina laimennuskäyrän mukaan (1:2, 1:4, 1:8 ja t. d.) sekoitettu normaali plasmanäyte. Tämä käyrä muodostetaan kerran tromboplastiineille, joilla on eri alkuaktiivisuus. (alkaen 12 että 18 alkaen) ja sitä käytetään protrombiiniindeksin määrittämiseen tutkituilla potilailla. Tämän tekniikan etu on myös se, että kaikkien tutkimusten tulokset, mukaan lukien ne, jotka suoritetaan dynaamisesti eri päivinä, eivät liity satunnaisiin erilaisiin normaalin veriplasman näytteisiin, ja samoihin vakioparametreihin, seurauksena menetelmän virhe pienenee merkittävästi. Indeksit, saatu normaalin plasman suhde- ja laimennuskäyrästä, täysin ristiriidassa keskenään. Tämä tulee ottaa huomioon myös epäsuorien antikoagulanttien vaikutusta seurattaessa., koska tavanomaisen indeksin alentaminen arvoon 50 % vastaa suunnilleen indeksin laskua laimennuskäyrällä 25-30 prosenttiin• Tältä osin analyysien tulee aina osoittaa, Miten protrombiiniindeksi laskettiin?, mitkä ovat sen tämän toiminnan tromboplastiinin standardiindikaattorit.
Plasman trombiiniaika
Plasman trombiiniaika, t. se on. sitratoidun plasman hyytymisaika, kun siihen lisätään normaaliaktiivista trombiinia, on tärkein testi veren hyytymisen loppuvaiheen arvioimiseksi. Tämän indikaattorin huomioon ottaminen on tärkeää kaikkien muiden koagulaatiotestien oikean tulkinnan kannalta, koska veren hyytymisen viimeisen vaiheen häiriintymisen pitäisi väistämättä johtaa hyytymisajan pidentämiseen kaikissa edellä mainituissa menetelmissä.
Useimmissa tapauksissa trombiinitestiä tehtäessä käytetään tätä trombiiniliuoksen pitoisuutta, joka sekoitettuna yhtä suureen tilavuuteen veriplasmaa tuottaa hyytymisen 12– 18 alkaen, mutta dysfibrinogenemiaa tunnistaessaan käytetään myös heikompia pitoisuuksia (joka johtaa koagulaatioon 30-35 sekunnissa).
Trombiiniaika - tärkeä diagnostinen indikaattori, sen rikkominen havaitaan synnynnäisenä, ja usein esiintyvillä hankituilla (toissijainen) hypoprotrombinemia, useimpien dysfibrinogenemioiden kanssa, ja myös hepariinin vaikutuksen alaisena, fibrinolyysituotteet (PDF) ja joukko muita antitrombiineja ja fibriinimonomeerien itsekokoamisen estäjiä. Tämän vuoksi trombiiniaika häiriintyy ensisijaisesti ja suuremmassa määrin akuuteissa ja subakuuteissa DIC-oireyhtymissä., jolla on tärkeä rooli tämän patologian nopeassa diagnosoinnissa.
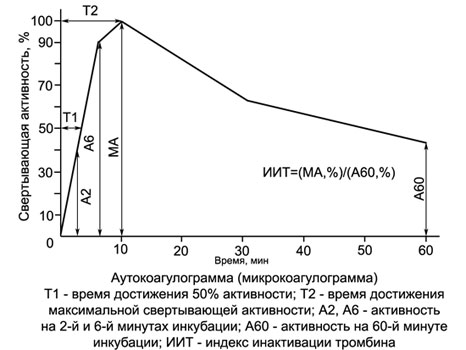
Autokoagulaatiotesti
Autokoagulaatiotesti (TOIMIA) - erittäin herkkä kaksivaiheinen, luonnehtii veren hyytymisprosessia, kun sen laukaisee sisäinen mekanismi. Sama kuin APTV, testi ei ole herkkä tekijä VII:n puutteelle, mutta samaan aikaan sen indikaatiot eivät riipu fibrinogeenipitoisuudesta (tekijä I) tutkitussa veriplasmassa, miten se eroaa kaikista muista indikatiivisista hyytymiskokeista.
Toinen ACT:n etu on se, että laimennettua verta testataan, josta johtuen testin herkkyys hyytymistekijöiden puutteelle ja, Lisäksi, ACT:n suorittaminen ei vaadi kaoliinin ja kefaliinin käyttöä, koska kontaktin ja fosfolipidiaktivaation standardointi siinä saavutetaan koehenkilön omien punasolujen hemolysaatilla.
ACT:n ydin on, mitä 2 ml hypotonista liuosta (0,222 %) kalsiumkloridia lisätään 0,1 ml kohteen verta.
Tässä hemolysaatti-kalsium-seoksessa muodostuu protrombinaasia ja trombiinia, joiden aktiivisuus määräytyy peräkkäisen lisäyksen avulla 0,2 ml tätä seosta 0,2 ml kohteen plasmaa (jokainen 2 min ensimmäisen aikana 10 m, ja sitten joka 10 min 1 ei).
Potilaan plasma on fibrinogeenin lähde, jolla testataan seoksessa muodostuneen trombiinin aktiivisuutta. Kuten monet tutkimukset ovat osoittaneet, se voidaan korvata terveiden ihmisten veriplasmalla tai fibrinogeeniliuoksella. Tässä tapauksessa potilaan verenkulutus pienenee 0,1-0,2 ml:aan (voidaan ottaa sormesta!), mitä muuntaa autokoagulaatiotestin mikrokoagulaatiotestiksi (ICT) ja tekee siitä erittäin kätevän lastenlääketieteessä, mukaan lukien vastasyntyneiden hemostaasia tutkittaessa.
Koagulaatioaktiivisuus ACT:ssä ja MCT:ssä aluksi kasvaa ja saavuttaa maksiminsa terveillä ihmisillä yleensä 10. minuuttiin mennessä, veri-kalsium-seoksen inkubointi (KCS), kun substraattiplasman koaguloituminen tapahtuu 10±1 sekunnissa. Sitten CCS:n hyytymisaktiivisuus alkaa laskea, mikä osoittaa siihen muodostuneen trombiinin inaktivoitumisen. Hemofiliaan, altistuminen hepariinille ja muille hyytymishäiriöille, CCS:n hyytymisaktiivisuus vähenee jyrkästi, ja maksimi siirtyy 10. minuutista myöhempään ajankohtaan. Hyperkoagulaation yhteydessä havaitaan aikaisempaa ja merkittävämpää trombiiniaktiivisuuden kasvua CCS:ssä.
Kun testi suoritetaan yhdessä putkessa (määritys vasta CCS:n inkuboinnin 10. minuutilla) sitä voidaan käyttää hepariinihoidon seurantaan. Tämän tekniikan etuna aktivoituun osittaiseen tromboplastiiniaikatestiin verrattuna on se, että se neutraloi eri kefaliinien epätasaisen vaikutuksen hepariinin hyytymisaikaan.
Perustuu ACT:hen (ICT) Yksinkertainen ja tarkka menetelmä hemofilian erotusdiagnoosiksi on kehitetty.
Käyttämällä hakuteoksissa annettuja muunnostaulukoita, ACT-lukemat (ICT) voidaan ilmaista prosentteina ja kuvata kaaviona - autokoagulogrammi.
Instrumentaalisia tutkimusmenetelmiä käytetään myös laajalti useiden veren hyytymisen yleisten parametrien arvioinnissa., pääasiassa erilaisia koagulografeja ja tromboelastografeja.
Tromboelastografia antaa käsityksen paitsi veren tai plasman hyytymisen aikaparametreista, mutta myös muodostuvien hyytymien rakenteesta ja mekaanisista ominaisuuksista. Viime vuosina koagulaatioprosessin kontaktin ja fosfolipidiaktivoinnin standardointi on otettu käyttöön laitteiston rekisteröintimenetelmissä.. Koagulogrammeja luodaan myös yleisten koagulaatiotestien massasuoritukseen - APTT, protrombiini, trombiini ja muut automaattisen tulosten tallennuksen avulla.
Menetelmät erilaisten hyytymistekijöiden puutteiden erottamiseksi ja niiden kvantifiointi
Alla olevan taulukon tiedot osoittavat, että ohjeellinen veren hyytymistutkimus, jossa käytetään kolmea päätestiä, mahdollistaa erilaisten plasman hemokoagulaatiotekijöiden puutteen ryhmien erottamisen. Niin, hyytymisen hidastuminen vain protrombiinitestissä (Tyypin I rikkomukset) normaaleissa lukemissa kaikille muille, se on tyypillistä tekijä VII:n perinnölliselle puutteelle tai tämän tekijän tason laskulle obstruktiivisen keltaisuuden kehittymisen alkuvaiheessa tai ensimmäisten 1-2 päivän aikana epäsuorilla antikoagulantteilla., kun tekijä VII:n synteesin estyminen etenee sen kehityksessä, kaikkien muiden K-vitamiinista riippuvaisten hyytymistekijöiden taso laskee.
Tärkeimpien hyytymiskokeiden rikkomusten tyypit, joissa on tiettyjen plasman hyytymistekijöiden puute | ||||
Rikkomusten tyyppi | Puutteelliset tekijät tutkitussa veriplasmassa | Koagulaatiotestit | ||
APTV, TOIMIA | PV | TV | ||
| Minä | VII | – | + | – |
| II | XII | + | – | – |
| XI | + | – | – | |
| IX | + | – | – | |
| VIII | + | – | – | |
| von Willebrandin tekijä | + | – | – | |
| Plasman prekallikreiini | + | – | – | |
| VM kininogeeni | + | – | – | |
| III | II | + | + | – |
| V | + | + | – | |
| X | + | + | – | |
| VII | – | + | – | |
| IX | + | – | – | |
| Minä | + | + | + | |
| XIII | – | – | – | |
| IV | Suorat antikoagulantit (Hepariini, heparinoidit jne.) | + | + | + |
| Epäsuorat antikoagulantit (kumarinы) | + | + | – | |
| Huomata. (+) - hidastaa hyytymistä; (-) - ei hyytymishäiriötä. | ||||
Vain sisäisen hyytymismekanismin häiriö, t. se on. aktivoitunut osittainen tromboplastiiniaika ja ACT (Tyyppi II), havaittiin tekijä XII:n puutteella, XI, IX, VIII, von Willebrand (ei kaikissa muodoissa), prekallikreiini ja BM-kininogeeni. Näistä perinnöllisissä hyytymishäiriöissä tekijä XII:n puutos, prekallikreiiniä ja VM-kininogeenia havaitaan erittäin harvoin, eikä niihin liity verenvuotoa, kun taas tekijä VIII:n puutos (hemofilia A), IX (Hemofilia B) ja von Willebrand -tekijä on hyvin yleinen (on suurempi kuin 96 % kaikki perinnölliset koagulopatiat) ja siihen liittyy vakava verenvuoto. Niiden välillä suoritetaan ensinnäkin lisäerotusdiagnoosi..
Tekijän XI puutos on suhteellisen harvinainen (noin 0,5-1,0 % kaikki hemofiliat), esiintyy erittäin lievän verenvuodon yhteydessä (lähinnä vammojen ja leikkausten jälkeen) ja se on oireettomien sairauksien ensimmäisen alaryhmän ja hemofilian ja von Willebrandin taudin välissä.
Toiselle häiriötyypille on tunnusomaista sekä osittaisen tromboplastiiniajan että ACT:n piteneminen, ja protrombiiniaika. Se on ominaista tekijä V:n puutteelle, X tai II tai kaikkien K-vitamiinista riippuvaisten tekijöiden monimutkainen puutos (VII, X, IX, II), mitä havaitaan obstruktiivisessa keltaisessa ja muun tyyppisessä K-vitamiinin puutteessa, ja myös käytettäessä epäsuoria antikoagulantteja.
Lopuksi, kuten samasta taulukosta näkyy, Kaikkien kolmen testin mahdollinen rikkominen (Tyyppi IV), mitä havaitaan perinnöllisissä ja hankituissa hypoksissa- ja dysfibrinogenemia (eivät kaikki), kun käytät suoria antikoagulantteja (geparina, heparinoideja, Girudin ja muut.), hoito fibrinolyysiaktivaattoreilla ja defibrinaatiolääkkeillä (streptokinaasi, urokinaasi jne.), patologisten antitrombiinien ja aineiden esiintyminen veressä, estämällä yhteyden (kokoonpano) fibriinimonomeerit - paraproteiinit, kryoglobuliinit, immuunikompleksit, sekä monimutkaisiin verenvuotohäiriöihin, DIC-oireyhtymän aiheuttama. Tässä tapauksessa trombiiniaika häiriintyy usein enemmän ja jonkin verran aikaisemmin, kuin muut testit.
Ottaen huomioon taudin kesto ja mahdollisuus sen perinnölliseen syntymiseen tai sekundaariseen yhteyteen muuntyyppisiin patologisiin ja lääketieteellisiin tai muihin vaikutuksiin, läsnäolo tai puuttuminen verenvuotoa ja sen tyyppiä ei oikein tunnistaa syntyhistoria näiden syvä veren hyytymishäiriöitä.
Kaikki erottaa testit perustuvat periaatteeseen korjauksen, t. se on. määrittämiseksi, missä määrin paljasti verenvuotohäiriö tai poistuvat, kääntäen, Se jatkuu verinäytteistä plasma tai veren saadut tuotteet keinotekoisesti selkeästi tiedossa puutos hyytymistekijän.
Tätä tarkoitusta varten erikoistuneet laboratoriot luovat itselleen kokoelmia tekijäpuutteellisista veriplasmoista, saada niitä potilailta, joilla on tunnetusti syvä (vähemmän 1 %) kunkin tekijän puute ja varastoi ne pienissä pakkauksissa (mennessä 0,5 ml) lämpötilassa - 30 ° C. Tarvittaessa nämä näytteet sulatetaan ja niitä käytetään diagnostisissa testeissä..
Plasma, подвергшаяся случайному размораживанию или оставшаяся неиспользованной, повторному замораживанию не подлежит. В коррекционных тестах не следует использовать плазму с иммунными ингибиторами того или иного фактора. В диагностических наборах ряда фирм содержатся лиофильно высушенные образцы плазмы крови с дефицитом определяемых факторов свертывания (субстратные плазмы). Однако многие нарушения свертываемости крайне редко наблюдаются в клинической практике, в связи с этим используются искусственно приготовленные компоненты нормальной крови с дефицитом тех или иных факторов свертывания, а также гетерогенные плазмы (цыплят, утят и др.).
В таблице приведены сведения о содержании факторов свертывания крови в компонентах крови, используемых для проведения коррекционных коагуляционных тестов в зависимости от сроков их хранения. Пользуясь этой таблицей, легко расшифровать показания любого из трех основных коагуляционных тестов. В коррекционных методиках такого рода используются тесты, стандартизированные по контакту и фосфолипидной активации, t. se on. каолин-кефалиновые или с применением гемолизата (в АКТ).
Содержание факторов свертывания а плазме крови с различными сроками хранения, используемой для проведения коррекционных тестов | ||
Плазма крови | Фактор свертывания | |
внутреннего механизма | внешнего механизма | |
VIII IX XI XII прекалликреин | VII X V II | |
| Нативная (со сроком хранения до 18 ei) | ++++ | ++++ |
| Адсорбированная * | +-++ | –+- |
| Со сроком хранения более 24 ei | -+++ | ++– |
| Со сроком хранения 2—4 дня (при температуре +4°С) | Не используется | ++-+ |
| Профильтрованная ** | Не используется | –++ |
| Нативная плазма цыплят или утят (в возрасте до 3—4 дней) | +++- | Не используется |
| Huomata. (+) — наличие фактора; (-) — отсутствие. | ||
| * Адсорбция производится либо сульфатом бария из оксадаткой плазмы (BaSO4-plasma). либо гелем гидроокиси аллюминня из цитратной плазмы (Voit(VOI)3-plasma). | ||
| ** Фильтрация производится через два асбестовых фильтра (фильтры Зейца) — с 20 % (верхний фильтр) ja 30 % (нижний фильтр) содержанием асбеста либо через удвоенный или утроенный соответственно 30 ja 20 % фильтры. | ||
Тесты смешивания плазмы крови больного с плазмой, имеющей заведомо известный дефицит того или иного фактора
Определяют активированное парциальное тромбопластиновое время в исследуемой плазме крови, нормальной плазме (контроль) ja plasmassa, jossa tiedetään olevan tekijä VIII:n puutos (potilaalta, jolla on hemofilia A), IX (potilaalta, jolla on hemofilia B), XI ja XII. Sitten koehenkilön sitraattiplasmanäytteistä valmistetaan seos. (7/10 äänenvoimakkuutta) и последовательно с каждой из дефицитных плазм (3/10 äänenvoimakkuutta), начиная с дефицита фактора VIII и IX (наиболее частые формы патологии!).
К смеси добавляют каолин и кефалин, ja 2 мин подвергают ее рекальцификации (at 37 ° C). В той смеси, где активированное парциальное тромбопластиновое время не нормализуется, имеется один и тот же дефект свертывания.
Niin, если у обследуемого больного активированное парциальное тромбопластиновое время не нормализуется добавлением плазмы крови больного с заведомо известным дефицитом фактора VIII, но корригируется плазмой крови больного с дефицитом фактора IX, у него имеется hemofilia A.
Samoin, но на основе протромбинового теста дифференцируют дефицит факторов протромбинового комплекса (X, V, VII и II).
Тест генерации тромбопластина
Для дифференциации нарушений внутреннего механизма свертывания крови чаще всего используется классический тест генерации тромбопластина с заменой тромбоцитарного компонента, приготовление которого требует значительной затраты времени и крови, кефалином Недостатками теста генерации тромбопластина являются его громоздкость, необходимость приготовления большого числа реагентов, значительная затрата времени на его выполнение.
Коррекционный тест, основанный на базе аутокоагуляционного теста.
Задачам экспресс-диагностики вполне отвечает другой коррекционный тест, основанный на проведении коррекции теми же компонентами нормальной крови на базе аутокоагуляционного теста.
Этот тест отличается высокой надежностью, быстротой и легкостью выполнения и требует небольшого (ei enää 0,5 ml) количества крови исследуемого, что позволяет использовать его в педиатрической практике.
В нем, kuten tromboplastiinin muodostumistestissä, Korjaukseen käytetään adsorboitua plasmaa ja vanhaa veriseerumia, joka sentrifugoidaan uudelleen ennen tutkimusta. В три пробирки разливают по 2 ml 0,222 % раствора хлорида кальция и в две из них добавляют 0,1 мл адсорбированной нормальной плазмы крови (1-я пробирка) ja 0,1 мл старой нормальной сыворотки крови (2-я пробирка). В три другие пробирки вносят по 0,2 мл нормальной цитратной плазмы. Затем во все пробирки с раствором хлорида кальция добавляют по 0,1 мл цитратной крови исследуемого.
Ровно через 4 мин инкубации этой смеси ее свертывающую активность тестируют на нормальной плазме.
Резкое снижение коагулирующей активности только в первой пробирке (с нормальной BaSO4-плазмой) свидетельствует о наличии у больного дефицита фактора IX (Hemofilia B), только во второй пробирке (со старой сывороткой) — о дефиците фактора VIII (hemofilia A); если коррекция происходит в обеих пробирках (одинаково сильная), sitten, ilmeisesti, имеется дефицит фактора XI или XII (cm. Pöytä. 14).
Koagulaatiotestit, дифференцирующие нарушения свертывания крови по внутреннему механизму (при нормальном протромбиновом и тромбиновом времени) | |||
Puutteelliset tekijät tutkitussa veriplasmassa | Компоненты нормальной крови, добавляемые к исследуемой плазме | ||
Адсорбированная плазма (без фактора IX) | Старая сыворотка (без фактора VIII) | Смесь адсорбированной плазмы и старой сыворотки | |
| Фактор VIII | + | – | + |
| Фактор IX | – | + | + |
| Факторы XI или XII | + | + | + |
| Huomata. (+) — нормализация свертывания; (-) — отсутствие нормализации свертывания. | |||
Данный тест высокочувствителен, так как исследование проводится на разведенной в 20 раз крови при компенсации фактора 3 тромбоцитов гемолизатом. Единственный используемый реактив — гипотонический раствор хлорида кальция, что делает пробу общедоступной.
Столь же простой является методика коррекционных проб, выполняемых на основе протромбинового теста для дифференциации дефицита факторов II, V и VII+, X (taulukossa).
Koagulaatiotestit, дифференцирующие дефицит факторов II, V и VII+, +X, выполняемые на основе протромбинового теста (при нормальном тромбиновом времени) | ||||
Puutteelliset tekijät tutkitussa veriplasmassa | Компоненты нормальной крови, добавляемые к исследуемой плазме | |||
Адсорбированная плазма (без факторов II, VII, X) | Старая плазма (без фактора V) | Профильтрованная плазма (без факторов VII и X) | Старая сыворотка (без факторов II и V) | |
| Факторы VII или X | – | + | – | + |
| Фактор V | + | – | + | – |
| Фактор II | – | + | + | – |
| Huomata. (+) — нормализация свертывания; (-) — отсутствие нормализации свертывания. | ||||
Для того чтобы разграничить дефицит факторов VII и X, выполняется дополнительный коагуляционный тест с добавлением к исследуемой плазме крови раствора яда змеи гюрзы — препарат лебетокс (подбирается такая концентрация яда, которая в присутствии кефалина и хлорида кальция вызывает свертывание за 20—25 с; все ингредиенты берутся в количестве 0,1 мл и смешиваются) (таблица ниже).
С этой же целью используется препарат яда гадюки Расселла, обитающей в Индии (valmistelu стипвен).
Koagulaatiotestit, дифференцирующие дефицит факторов VII и X с помощью яда гюрзы (лебетокс) | |||
Puutteelliset tekijät tutkitussa veriplasmassa | Testit | ||
с ядом гюрзы+кефалин+хлорид кальция | kyykäärme + kefaliini + kalsiumkloridi + suodatettu veriplasma (tekijöiden lähde V a VIII) | protrombiini | |
| Tekijä X | – | – | – |
| Tekijä VII | – | + | + |
| Huomata. (+) — нормализация свертывания; (-) — отсутствие нормализации свертывания. | |||
Дифференциальную диагностику завершают при необходимости количественным определением дефицитных факторов или их специфических иммунных ингибиторов, для чего применяются специальные высокочувствительные стандартизированные методики. В этих методиках используется построение кривых разведения смешанных образцов нормальной плазмы крови с коррекцией дефицита всех факторов, кроме исследуемого. По этим кривым определяется активность исследуемого фактора в плазме больных.
Varsinkin важно количественное определение концентрации факторов VIII и IX, а также наличия их ингибиторов у больных гемофилией А и В (особенно до и во время хирургических вмешательств и при проведении интенсивной заместительной терапии), а также при отсроченных профузных послеродовых кровотечениях, когда приходится дифференцировать ДВС-синдром и более редкую патологию — появление иммунного ингибитора фактора VIII (еще намного реже — фактора V).
При глубоком дефиците фактора XIII (очень редкая наследственная патология) все коагуляционные пробы нормальны, но сгустки растворяются в 5М или 7М мочевине.
Помогает дифференцировать дефицит различных факторов свертывания также и учет степени и, erityisesti, сроков нормализации показаний тестов после внутривенного введения больным препаратов крови, t. se on. учет коррекции elää по методике Л. 3. Баркагана.
Особенно эффективна эта методика при большой разнице продолжительности жизни дифференцируемых факторов в циркуляции. Niin, продолжительность полужизни факторов протромбинового комплекса варьирует от нескольких часов (фактор VII) до нескольких дней (фактор II). Промежуточное положение между ними занимают факторы X (2—2,5 дня) и V (12—18 ч).
Поэтому после массивной струйной трансфузии плазмы протромбиновый индекс повышается при дефиците фактора VII очень кратковременно, при дефиците фактора V — несколько более длительно (примерно в 4—6 раз), а при дефиците факторов X и, erityisesti, II на более продолжительный срок (свыше 1—2 суток). Показательно в этом отношении и влияние на протромбиновый индекс препарата ППСБ (концентрата факторов VII, IX, X iloa). Он также кратковременно нормализует протромбиновое время при дефиците фактора VII и более длительно (во много раз!) при дефиците факторов X и II. Поскольку в этом препарате отсутствует фактор V, данный дефицит им не корригируется.
Аналогичное различие выявляется при трансфузионной и заместительной терапии факторов внутреннего механизма свертывания (XII, XI, IX и VIII), что регистрируется активированным парциальным тромбопластиновым тестом.
Особый интерес представляет динамика коррекции уровня фактора VIII и показаний АПТВ при трансфузионной терапии гемофилии А и болезни Виллебранда. Ensimmäisessä näistä sairauksista veren hyytymisessä on välitön, maksimaalinen paraneminen verensiirron jälkeen. (spray, nopea!) antihemophilus-plasman tai kryoprecipitaatin antaminen, а затем довольно быстрое (за 10—18 ч) неуклонное снижение ее, тогда как при болезни Виллебранда наблюдается некоторое нарастание свертывающей активности в течение нескольких часов после трансфузии, а затем ее снижение — намного более медленное, чем при. В связи с этим при лечении болезни Виллебранда более редко прибегают к заместительным трансфузиям, чем при гемофилии А.
Hyytymistekijöiden ja kallikreiini-kiniini- ja fibrinolyyttisten järjestelmien komponenttien toiminnallisen aktiivisuuden tutkimus kromogeenisia substraatteja käyttäen
Методы основаны на исследовании активности протеолитических ферментов и их ингибиторов, участвующих в свертывании крови, фибринолизе и образовании кининов, Näille entsyymeille spesifisesti herkkien peptidien intensiteetin ja katkaisunopeuden perusteella, hajoamisen yhteydessä väriainetta vapautuu (p-nitroaniliini).
Reagoivan seoksen väriaste määritetty spektrofotometrisesti, ja sen intensiteetin perusteella vastaavien entsyymien aktiivisuus arvioidaan (hyytymistekijä, kallickreina, plasmiini ja muut.), а по торможению процесса — об активности ингибиторов ферментов.
Niin, esimerkiksi, действие гепарина и антитромбина III может быть оценено по ослаблению расщепления хромогенных субстратов фактором Xa или тромбином, а активность α2-антиплазмина — по ослаблению действия плазмина на соответствующий хромогенный субстрат. Хромогенные субстраты либо имеют цифровое обозначение (esimerkiksi, s-2222), tai niitä kutsutaan kromosiineiksi lyhennetyllä etuliitteellä, tarkoittaa sitä entsyymiä, joille tämä substraatti on herkkä (esimerkiksi, Chromozym PL on plasmiinin substraatti, Chromozym TH - trombiinin substraatti, Chromozym PK — prekallikreiini/kallikreiinisubstraatti jne. d.).
Kromogeeniset substraatit laajentavat mahdollisuuksia tutkia hemostaasijärjestelmää, mutta ei vielä tarpeeksi saatavilla monille laboratorioille. Некоторые исследования, выполненные с их помощью, не имеют преимуществ перед обычными коагуляционными тестами и дают совпадающие с ними результаты; в других случаях их использование упрощает и ускоряет исследование, делает его более точным; в третьих — эти методики имеют самостоятельное значение и не могут быть заменены коагуляционными тестами (esimerkiksi, определение прекалликреина).
Иммунологическое определение компонентов системы гемостаза
Иммунологическое определение компонентов системы гемостаза выполняется методами:
- Иммунопреципитации;
- Иммуноэлектрофореза;
- Радиоиммунологическими и другими с соответствующими антисыворотками
При этом оценивается содержание в плазме крови антигена того или иного фактора свертывания (или его фрагментов), а не функциональная активность, которая может быть резко сниженной при нормальном содержании антигена в плазме. Такая ситуация характерна для всех тех случаев, когда в организме синтезируются аномальные (функционально неполноценные) tekijät, сохраняющие свою антигенность, но лишенные способности участвовать в гемостазе.
Это позволяет разграничивать полное прекращение синтеза соответствующих факторов и образование их аномальных форм.
Вместе с тем ряд компонентов системы гемостаза может определяться только иммунологически.
В эту группу входят такие важные исследования, как определение следующих компонентов:
- β-тромбоглобулина;
- α2-макроглобулина;
- протеинов C и S;
- антигенов факторов VIII:C и VIII:R -cof;
- fibrinolyysituotteet (PDF);
- неоантигенов комплексов тромбин — антитромбин III и плазмин — антиплазмин;
- ряд других тестов.
Поэтому иммунологическое исследование существенно дополняет функциональную оценку разных звеньев системы гемостаза.
Diagnostiset testit, основанные на использовании в качестве реагентов препаратов из змеиных ядов
Давно установлено, что яды многих змей содержат высокоактивные протеолитические ферменты, вызывающие свертывание крови и воздействующие на разные звенья коагуляционного каскада. Вследствие этого змеиные яды и выделенные из них коагулазы широко используются для распознавания нарушений гемостаза, количественного определения факторов свертывания, выявления и количественного определения растворимых фибрин-мономерных комплексов (RFMK) и ряда других исследований.
Пробы со змеиными ядами часто намного упрощают и делают более оперативной диагностику нарушений гемостаза.
В таблице приведены данные о механизме действия ядов на свертывающую систему крови и возможностях диагностического использования каждого из них.
Гемокоагулирующие свойства змеиных ядов и их использование в диагностической практике | |||
Наименование змей * и препаратов из их ядов | Механизм действия на свертывающую систему | Отличия от свойств естественных факторов свертывания | Возможности диагностического применения |
| Гюрза Vipera lebetina); лебетокс (гадюка Расселла; стипвен) | Активатор фактора X (в присутствии кальция, фактора V и фосфолипида **) | В отличие от тканевого тромбопластина не содержит фосфолипида и не компенсирует его дефицита. Не нуждается для реализации свертывания в факторе VII | Определение фактора и тромбоцитов и его освобождения при агрегации; разграничение дефицита факторов VII и X; количественное определение фактора X |
| Эфа многочешуйчатая (Echis multisgumatos) и эфа песчаная (Echis carinatus); экарин, эхитокс | Активатор фактора II, образует атипичный тромбин-Ем | В отличие от α-тромбина, тромбин-Ем не блокируется гепарином и антитромбином III, не активирует фактора XIII (сгустки лизируются в мочевине), коагулирует весь пул фибриногена и все растворимые комплексы фибрин-мономеров | Выявление гиперкоагуляции, в том числе скрытой, при лечении гепарином; kokonaisfibrinogeenin ja RFMC:n kvantitatiivinen määritys trombinemian ja DIC:n diagnosoimiseksi- oireyhtymä |
| Tavallinen puuvillasuu (Aghistrodon sileä sileä), sekä monet trooppisen Amerikan ja Aasian kalkkarokäärmeet; ancistron-N1-, reptilaza, botropklotaza, krotalaza, Ancrod jne. | Hyytymiä fibrinogeeni, pilkkomalla vain peptidit ja fibriinimonomeereiksi muodostavat puutteelliset (des--fibriini) | Ei pilkkoo peptidit, Se aktivoi tekijän XIII ja verihiutaleet, Se aiheuttaa takaisinveto veritulppien, Se ei ole estänyt hepariinia, nopeasti hajottavat hyytymiä | Tunnustaminen disfibrinogenemy; arviointi roolin hepariinin vastaisesti loppuvaiheessa hyytymisen (versus Trombiiniajan) |
| * Kaikki nämä käärmeet elävät Keski-Aasiassa (в скобках указаны другие виды со сходным механизмом действия и фирменные препараты из них; гадюка Расселла обитает в Индии, гадюка Дабойа — в Австралии. | |||
| ** Аналог кефалина и тромбоцитарного фактора 3. | |||
Эти возможности еще более расширяются при одновременном использовании нескольких ядов и простейших общих коагуляционных тестов. Niin, esimerkiksi, Hyytymistestien samanaikainen käyttö kyykäärmeen ja efa-myrkyn kanssa mahdollistaa tekijä VII -vajeen erottamisen helposti, X-V ja II (alla olevassa taulukossa), ja lisäksi korjauksen suodatetaan normaalia plasmaa (tehokerroin V ja II) -defitsit tekijät X ja V.
Koagulaatiotesteissä eri myrkyt, erottaa alijäämä protrombiinikompleksia | |||
Puutteelliset tekijät tutkitussa veriplasmassa | Testit | ||
viper venom Kefalonia | myrkkyä ephan | protrombiini | |
| VII | + | + | – |
| X V | – | + | – |
| II | – | – | – |
| Huomata. (+) — нормализация свертывания; (-)-no normalisoituminen hyytymisen. | |||
Määrittäminen fysiologisten antikoagulantit
Tärkein on aktiivisuuden määritystä tärkeimmät fysiologisen antikoagulanttien - antitrombiini III, vähennys, joka voidaan geneettisiä (primaarinen trombofilia) либо вторичным вследствие интенсивного потребления (DIC, массивные тромбозы) или ускоренного метаболизма (лечение гепарином, L-аспарагиназой, синтетическими контрацептивными средствами) и блокады иммунными комплексами, парапротеинами, фибронектином, белками острой фазы.
В любом случае снижение активности антитромбина III ниже 60—65 % поддерживает внутрисосудистое свертывание крови, делает менее выраженным антикоагулянтное действие гепарина. Kuitenkin hyvin usein välillä tason antitrombiini III ja laski herkkyys hepariini ei lakia ole noudatettu.
Se on yleensä heikentyminen antikoagulanttivaikutusta hepariinin huomattavasti syrjäyttää asteen lasku antitrombiinin III. Osoittautui, että alijäämät eri muodoissa sen antitrombiini III affiniteetti hepariinin voivat vaihdella eri asteita. Lisäksi, Eri jakeet hepariinia, suhde, joka on lääkkeiden hyvin vaihteleva, on myös erilainen affiniteetti antitrombiini III. Поэтому практически важно исследовать как собственно активность антитромбина III, так и его способность превращаться под влиянием гепарина в быстродействующий антикоагулянт.
Антикоагулянтная активность антитромбина III
Антикоагулянтная активность антитромбина III определяется по способности исследуемой плазмы крови (разведенной — метод Копли—Винтерштейна или дефибринированной тепловой денатурацией at 56 °С — методы Лолигера, Абильдгаарда и др.) инактивировать в течение определенного срока вводимый извне тромбин. Остаточная активность тромбина в такой плазме может определяться по ее свертывающей активности (на фибриногене, адсорбированной сульфатом бария плазме) либо по расщеплению хромогенного субстрата, чувствительного к тромбину или фактору Xa (поскольку антитромбин III инактивирует и этот фактор).
Гепарин-кофакторная активность
Гепарин-кофакторная активность содержащегося в плазме крови антитромбина III длительный период определялась с помощью теста толерантности плазмы к гепарину, который может считаться ориентировочным, поскольку дает очень большой разброс нормальных показателей и недостаточно воспроизводим.
Значительно более точны и воспро изводимы тесты, в которых исследуется влияние различных концентраций гепарина на тромбиновое время исследуемой плазмы, содержащей небольшое количество тромбоцитов. Сравнение проводится с удлинением тромбинового времени контрольной нормальной плазмы крови, к которой добавляются те же образцы гепарина.
Niin, в тромбин-гепариновом тесте к исследуемой плазме крови добавляются такие количества гепарина, которые в контроле удлиняют тромбиновое время с 15 до 32—35 с (малая концентрация) и до 95—110 с (высокая концентрация гепарина). По этим данным рассчитываются индексы активности антитромбинов плазмы (ААП) и антикоагулянтного резерва плазмы (АРП).
Также широко используются сходные методики с оценкой степени инактивации тромбина как в коагуляционных тестах, так и на хромогенных субстратах.
Иммунологическое определение антигена антитромбина III
Иммунологическое определение антигена антитромбина III позволяет дифференцировать различные виды тромбофилии:
- с недостаточным синтезом антитромбина III (уровень антигенного маркера снижен адекватно снижению активности);
- с сохраненным синтезом аномальных и функционально неполноценных его форм (уровень антигенного маркера намного выше, чем активность).
Протеины C и S, тромбомодулин и α2-макроглобулин определяются иммуноэнзиматическими методами.
