Adveit: juhised ravimi kasutamiseks, struktuur, Vastunäidustused
Kliiniline ja farmakoloogiline rühm: Valmistamine faktor VIII hüübimist
Farmakoterapeutiline rühm: Hemostatic
Adveit: farmakoloogiline toime
VIII faktori/Willebrandi faktori kompleks koosneb kahest molekulist (faktor VIII ja von Willebrandi faktor), millel on erinevad füsioloogilised funktsioonid. Ravim toodeti rekombinantse tehnoloogia abil hiina hamstri munasarjarakkude kultuuris, tootmisprotsessi käigus ei ole lisatud inim- ega loomset päritolu valke.
Ettevalmistus Adveit® sisaldab rekombinantset VIII hüübimisfaktorit (oktokog alfa), mis on aminohappejärjestusega glükoproteiin, sarnane inimese VIII faktoriga.
Oktokog alfa on glükoproteiin, koosnevad 2332 ligikaudse molekulmassiga aminohapped 280 kDa. Patsientidele manustamisel seondub oktokog alfa endogeense von Willebrandi faktoriga.. Aktiveeritud VIII faktor toimib aktiveeritud IX faktori kofaktorina, teguri X muundumise kiirendamine aktiveeritud faktoriks X. Aktiveeritud faktor X soodustab protrombiini muundumist trombiiniks. trombiin, vastutasuks, soodustab fibrinogeeni muundumist fibriiniks, mis viib trombi moodustumiseni (verehüüve).
Hemofiilia A on pärilik, sooga seotud, vere hüübimissüsteemi rikkumine koos VIII faktori aktiivsuse taseme langusega. Kliiniliselt väljendub rikkalik verejooks liigestesse, lihastes või siseorganites, kui spontaanne, ja mis on tingitud traumast või operatsioonist. Asendusravi ajal suureneb VIII faktori tase plasmas, mille tulemuseks on faktorvaeguse ajutine korrigeerimine vereplasmas ja kalduvuse vähenemine veritsuse suurenemisele.
Adveit: farmakokineetika
Kõik Adveiti farmakokineetilised uuringud® viiakse läbi patsientide osalusel, varem ravitud raske või mõõdukalt raske hemofiilia A tõttu (algväärtus VIII faktor ≤2%). Üldiselt, aastal saadi kokkuvõtlikud farmakokineetilised andmed ja neid analüüsiti 195 varem ravitud patsiendid, raske hemofiiliaga A (algtaseme VIII faktor <1%).
Tabel 1. Adveiti farmakokineetilised parameetrid® raske hemofiiliaga A erinevate vanuserühmade patsientidel (algtaseme VIII faktor <1%)
| Võimalus (keskmine ± standardhälve) | Väikelaste 1 vahe-<2 aasta (n = 5) | Lapsed 2-<5 aastat (n = 30) | Lapsed 5-<12 aastat (n = 18) | Teismelised 12-<18 aastat (n = 33) | Täiskasvanud (n = 109) |
| AUC0-∞ (ME × h / dl) | 1362.1±311,8 | 1180.0±432,7 | 1506.6±530,0 | 1317.1±438,6 | 1538.5±529,1 |
| Kohandatud C taastamise koguneminemax (RÜ / dl RÜ / kg)* | 2.2±0,6 | 1.8±0,4 | 2.0±0,5 | 2.1±0,6 | 2.2±0,6 |
| T1/2 (ei) | 9.0±1,5 | 9.6±1,7 | 11.8±3,8 | 12.1±3.2 | 12.9±4.3 |
| Cmax plasmas pärast infusiooni (ME / dl) | 110.5±30,2 | 90.8±19,1 | 100.5±25,6 | 107.6±27,6 | 111.3±27,1 |
| Keskmine plasma tsirkulatsiooniaeg (ei) | 11.0±2,8 | 12.0±2,7 | 15.1±4,7 | 15.0±5,0 | 16.2±6.1 |
| Vd tasakaaluolekus (dl / kg) | 0.4±0,1 | 0.5±0,1 | 0.5±0,2 | 0.6±0,2 | 0.5±0,2 |
| Luba (ml /(кг×ч)) | 3.9±0,9 | 4.8±1,5 | 3.8±1,5 | 4.1±1,0 | 3.6±1,2 |
* Arvutatud kui (Alatesmax miinus VIII faktori algtase) jagada annusega (RÜ / kg), kus Cmax – VIII faktori maksimaalne tase, määratakse pärast sissejuhatust.
Adveiti ohutus ja hemostaatiline efektiivsus® lastel sarnane ohutuse ja hemostaatilise efektiivsusega täiskasvanutel.
Kohandatud taastumismäär ja T1/2 lõppfaasis patsientidel, kes on nooremad kui 6 aastad möödusid 20% vähem, kui täiskasvanutel, mis võib osaliselt olla seletatav laste suure plasmamahuga kehakaalu kilogrammi kohta.
Praegu puuduvad andmed ravimi Adveit farmakokineetika parameetrite kohta® patsientidel, varem ravimata.
Ravimi Adveit näidustused®
- veritsuse ravi ja ennetamine igas vanuses täiskasvanutel ja lastel, A hemofiiliat põdevad inimesed (pärilik VIII faktori puudulikkus).
Ettevalmistus Adveit® ei sisalda summas von Willebrandi faktorit, vajalik farmakoloogilise toime saavutamiseks, seetõttu ei ole see näidustatud von Willebrandi tõve raviks.
Avage ICD-10 koodide loend
Adveit: annustamisreżiim
Ravi ravimiga tuleb alustada arsti järelevalve all., kellel on kogemusi hemofiilia ravis, ja kui anafülaksia korral on võimalik viivitamatu elustamine.
Annused ja ravi kestus sõltuvad VIII faktori puudulikkuse astmest., verejooksu asukoht ja intensiivsus, samuti patsiendi kliiniline seisund. Asendusravi hoolikas laboratoorne jälgimine on eriti oluline suuremate operatsioonide ja eluohtlike verejooksude korral..
VIII faktori ravimite tugevust väljendatakse tavaliselt rahvusvahelistes ühikutes. (MINA), vastavalt WHO rahvusvahelistele standarditele. Plasma VIII faktori aktiivsust väljendatakse kas protsentides (võrreldes normaalse inimese plasmaga) või MINUS (võrreldes rahvusvahelise standardiga).
Üks rahvusvaheline üksus (MINA) VIII faktori aktiivsus on võrdne VIII faktori kogusega, mis sisaldub 1 ml inimese normaalse plasma.
Ravi “nõudlusel”
VIII faktori vajaliku annuse arvutamine põhineb empiirilistel andmetel, mille kohaselt VIII faktori valmistamine, doseeritud 1 Mina ja 1 kg kehakaalu, suurendab plasma VIII faktori aktiivsust 2 ME / dl.
Adveiti nõutav annus® defineeritakse valemiga:
Nõutav annus (MINA) = Kehakaal (kg) × nõutav % VIII faktori suurenemine × 0.5
Verejooksude ja kliiniliste olukordade puhul, näidatud tabelites 2 ja 3, VIII faktori aktiivsus ei tohiks langeda alla ettemääratud taseme (keeles väljendatud % normaalsest aktiivsusest või IU/dl) vastaval perioodil. Verejooksu episoodide ja kirurgiliste sekkumiste jaoks annuse ja manustamissageduse valimisel saate juhinduda tabelitest 2 ja 3.
Tabel 2. Ravimi Adveit kasutamine® erinevat tüüpi verejooksuga
| Verejooksu aste | Nõutav VIII faktori aktiivsus pärast manustamist (sisse % normaalne või RÜ/dl) | Sagedus (süstide vaheline intervall tundides)/Ravi kestus (päevade jooksul) |
| Hemartroosi esmased nähud, hemorraagia lihastesse või verejooks suus. | 20-40 | Süste korratakse iga kord 12-24 ei (iga 8-24 h noorematele patsientidele 6 aastat) vähemalt 1 päeva enne verejooksu, mida tõendab valu puudumine, või kuni täieliku taastumiseni. |
| Rohkem väljendunud hemartroos, lihaste verejooks või hematoom. | 30-60 | Süste korratakse iga kord 12-24 ei (iga 8-24 h noorematele patsientidele 6 aastat) jooksul 3-4 päeva või rohkem kuni valu leevenemiseni ja motoorse aktiivsuse taastumiseni. |
| eluohtlik verejooks. | 60-100 | Süste korratakse iga kord 8-24 ei (iga 6-12 h noorematele patsientidele 6 aastat) kuni verejooks täielikult peatub ja oht elule on kõrvaldatud. |
Tabel 3. Ravimi Adveit kasutamine® kirurgiliste sekkumiste ajal
| Operatsiooni tüüp | Nõutav VIII faktori aktiivsus pärast manustamist (sisse % normaalne või RÜ/dl) | Sagedus (süstide vaheline intervall tundides)/ravi kestus (päevade jooksul) |
| Väike operatsioon, sealhulgas hamba eemaldamine. | 30-60 | sisestage iga 24 ei (iga 12-24 h noorematele patsientidele 6 aastat) mitte vähem kui 1 päeva tervenemiseni. |
| Suured kirurgilised sekkumised. | 80-100 (enne ja pärast operatsiooni) | Süste korratakse iga kord 8-24 ei (iga 6-24 h noorematele patsientidele 6 aastat) kuni haava piisava paranemiseni, seejärel jätkake ravi vähemalt 7 päeva, VIII faktori aktiivsuse säilitamine vahemikus 30% kuni 60% (ME / dl). |
Annus ja manustamissagedus tuleb individuaalselt kohandada vastavalt kliinilisele vastusele.. Teatud asjaoludel (nt, madala tiitriga inhibiitorite juuresolekul) võib osutuda vajalikuks annuseid, ületab arvutatud.
Ravi käigus tuleb määrata VIII hüübimisfaktori tase plasmas, vajadusel kohandada annust või manustamissagedust.
Suuremate kirurgiliste sekkumiste läbiviimisel on kohustuslik jälgida asendusravi, määrates kindlaks VIII faktori aktiivsuse plasmas..
Patsientide kliiniline reaktsioon VIII faktori ravile võib olla erinev., farmakokineetiliste parameetrite erinevate väärtuste saavutamine, eriti, T1/2 ja taastumismäär in vivo.
Verejooksu ennetamine
Raske A-hemofiiliaga patsientide verejooksu pikaajaliseks ennetamiseks on annused tavaliselt vahemikus 20 kuni 40 VIII faktori ME 1 kg kehamassi kohta süstide vahelise intervalliga alates 2 kuni 3 päeva.
Ravimi kasutamine lastel
Ravimi kasutamisel režiimis “nõudlusel” Adveiti soovitatavad annused ja manustamise sagedus® sisse Lapsed vanuses 0 kuni 18 aastat sama, nagu täiskasvanud patsientidel. Pikaajaliseks verejooksu vältimiseks nooremad patsiendid 6 aastat ravimit soovitatakse kasutada annuses 20 kuni 50 VIII faktor ME 1 kg kehakaalu kohta 3-4 korda nädalas.
Manustamisviis
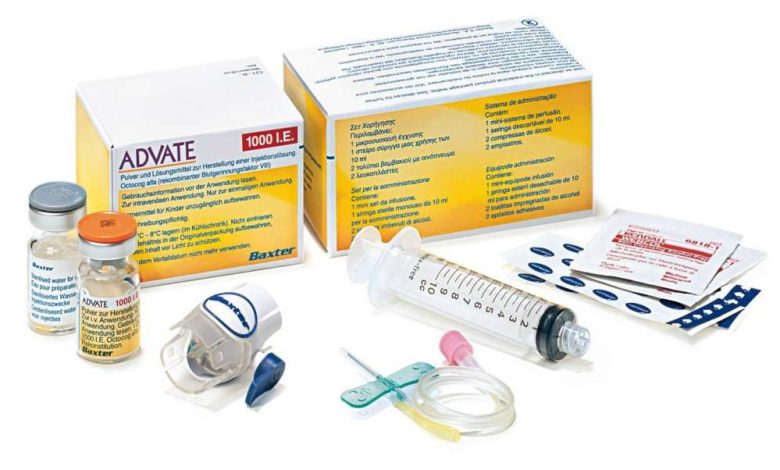
Ravim on ette nähtud eranditult intravenoosseks manustamiseks.. Kui ravimit manustab inimene, kellel ei ole eriarstiharidust, siis peaks see inimene saama Adveiti haldamise kohta asjakohase koolituse®. Ravimi manustamiskiirus tuleks valida nii, et pakkuda patsiendile maksimaalset mugavust. Manustamiskiirus ei tohiks ületada 10 ml / min. Soovitatav, patsiendi huvides, iga kord, kui ravimit manustate, kirjutage üles ravimi nimi ja partii number.
Ettevalmistus Adveit® tuleb manustada intravenoosselt pärast lüofilisaadi lahustamist steriilses süstevees. Valmistatud lahus peab olema selge, värvitu ja mehaaniliste lisanditeta. Ärge kasutage hägust lahust ega lahust, mis sisaldavad nähtavaid osakesi.
- Ravimi manustamiseks peate kasutama Lueri otsaga süstalt..
- Ravimit tuleb kasutada sees 3 h pärast taastumist.
- Ärge asetage lahustatud ravimit külmikusse.
- Kasutamata ravim või jäägid tuleb hävitada vastavalt kehtestatud nõuetele..
Aretus BAXJECT II seadmega
- Järgige aseptika reegleid.
- Ravimi lahustamiseks kasutage ainult steriilset süstevett ja lahjendusseadet, sisaldub pakendis.
- Ärge kasutage BAXJECT II seadet, kui selle steriilne tõkkesüsteem või pakend on kahjustatud, või kui märkate kahjustusi.
- Kui ravimit hoiti kuni lahjendamiseni külmkapis, Tooge Adveiti temperatuur® (lüofilisaat) ja steriilset süstevett (lahusti) kuni toatemperatuurini (15° kuni 25°C).
1. Pese oma käed, kasutades seepi ja kuuma vett.
2. Eemaldage lüofilisaadi ja lahusti viaalidelt korgid.
3. Pühkige pistikud alkoholiga lappidega. Asetage viaalid tasasele puhtale pinnale.
4. Avage BAXJECT II seadme pakend, eemaldades pabermembraani., pakendi sisu puudutamata. Ärge eemaldage seadet pakendist. Ära kasuta, kui BAXJECT II seade, selle steriilne tõkkesüsteem või pakend on kahjustatud.
5. Pöörake pakend ümber ja sisestage läbipaistev plastikots lahustiviaali korki. Pakendi servadest kinni haaramine, tõmmake üles ja eemaldage see BAXJECT II seadmest. Ärge eemaldage BAXJECT II seadmelt sinist katet.
6. Ravimi lahjendamiseks kasutage ainult steriilset süstevett., sisaldub pakendis. Kinnitades BAKSJECT II lahustiviaali külge, keerake süsteem niimoodi ümber, nii, et lahustipudel oleks seadme peal. Sisestage valge plastikots Advate viaali korki.® (lüofilisaat). Vaakumi tõttu voolab lahusti Adveitiga viaali®.
Pöörake viaali ettevaatlikult, kuni ravim on täielikult lahustunud.. Check, see kuulutus® (lüofilisaat) täielikult lahustunud, vastasel juhul ei liigu toimeaine seadme filtrist läbi. Ravim lahustub kiiresti (tavaliselt vähem kui 1 m). Valmistatud lahus peab olema selge, värvitu ja mehaaniliste lisanditeta.
Kasutusele ravim
Järgige aseptika reegleid.
Enne kasutamist tuleb lahustatud ravimit kontrollida mehaaniliste lisandite puudumise suhtes.. Kasutada tohib ainult selget ja värvitut lahust..
1. Eemaldage BAXJECT II seadmelt sinine kate. Ärge tõmmake süstlasse õhku! Süstige süstal BACSJECT II-sse.
2. Pöörake süsteemi (viaal valmislahusega peaks olema peal). Tõmmake valmistatud lahus süstlasse, tõmmates kolvi aeglaselt sisse.
3. Ühendage süstal lahti.
Ühendage libliknõel süstlaga. Lahust tuleb manustada sisse/sisse, aeglaselt. Ravimi manustamiskiirus ei tohiks ületada 10 ml / min. Enne Adveiti manustamist ja selle ajal® tuleb jälgida patsiendi pulsisagedust. Südame löögisageduse olulise tõusuga, ravimi manustamiskiiruse vähendamine või manustamise ajutine peatamine aitab enamikul juhtudel neid sümptomeid kiiresti peatada.
Adveit: kõrvalmõju
Adveiti kliinilistes uuringutes® osales 418 patsientidel, kätte saanud, kõige vähem, üks Adveiti manustamine®. Registreeriti 93 soovimatud ravimireaktsioonid (NLR). Kõige sagedamini teatatud kõrvaltoimed olid:: inhibiitorite ilmumine (neutraliseerivad VIII faktori vastased antikehad), peavalu ja palavik.
Ülitundlikkus või allergilised reaktsioonid (mis võib hõlmata angioödeemi, põletustunne ja sügelus süstekohas, külmavärinad, punetus, generaliseerunud urtikaaria, Peavalu, lokaliseeritud urtikaaria, gipotenziю, letargia, iiveldus, ängistus, taxikardiju, pitsitustunne rinnus, pistmine, oksendamine, ähkimine) täheldatud harva, kuid mõnel juhul arenes see raskeks anafülaksiaks (sealhulgas anafülaktiline šokk). Esineda võivad hiire ja/või hamstri valguvastased antikehad ja nendega seotud ülitundlikkusreaktsioonid.
A-hemofiiliaga patsientidel võivad tekkida neutraliseerivad antikehad (inhibiitorid) VIII faktori. Selliste inhibiitorite ilmnemine väljendub ebapiisava kliinilise vastusena.. Kõigil sellistel juhtudel on soovitatav pöörduda spetsiaalse hemofiiliakeskuse poole.
Allpool on andmed kõrvaltoimete esinemissageduse kohta, teave, mille kohta saadi kliinilistes uuringutes ja spontaansetest teadetest. Kõrvaltoimed liigitatakse elundite ja organsüsteemide kahjustuste järgi; organite ja organsüsteemide nimetused on antud vastavalt MedDRA terminoloogiale.
Kõrvaltoimete esinemissagedust hinnati vastavalt WHO NLR klassifikatsioonile vastavalt arengu sagedusele.: Sageli (≥1 / 10), sageli (≥1/100 kuni <1/10), harva (≥1/1000 kuni <1/100), harva (≥1 / 10 000 kuni <1/1000 ), harva (<1/10000), sagedus teadmata (ei saa olemasolevate andmete põhjal kindlaks teha). Igas sageduse astmes on kõrvaltoimed esitatud kahanevas raskusastmes.. Sagedus arvutati patsientide koguarvu suhtes, ravimi Advate saamine® (N = 418).
Nakkus- ja parasiithaigused: harva – gripp, laringit.
Verest ja lümfisüsteemist: sageli – VIII faktori inhibiitorite tekkiminekuni; harva – limfangit.
On osa immuunsüsteemi: sagedus teadmata – anafilakticheskaya reaktsioon, ülitundlikkuskuni.
Alates närvisüsteemi: sageli – peavalu; harva – peapööritus, mäluhäired, minestamine, värin, migreen, disgevziya.
On osa organ visioon: harva – silmapõletik.
Südame-veresoonkonna süsteemi: harva – südamepekslemine, hematoom, Kuumad Hood, kahvatus.
Hingamiselundeid: harva – hingeldus.
Alates seedesüsteemi: harva – kõhulahtisus, valu ülakõhus, iiveldus, oksendamine.
Naha ja nahaaluskoe poolt: harva – sügelema, lööve, liighigistamine, nõgestõbi.
Üldised häired ja häired süstekohas: sageli – palavik; harva – perifeerne turse, valu rinnus, ebamugavustunne rinnus, külmavärinad, muutus tervises, hematoom punktsioonikohas; sagedus teadmata – fatiguability, reaktsioonid süstekohal, vaevus.
Laboratoorsed ja instrumentaalsed andmed: harva – VIII hüübimisfaktori taseme langusja; monotsüütide arvu suurenemine, vähenemine, hematokriti, laboratoorsete uuringute tulemuste kõrvalekalle normist.
Vigastused, joobeseisund ja manipulatsioonide tüsistused: harva – protseduurijärgne komplikatsioon, protseduurijärgne verejooks, reaktsioon protseduuri kohas.
ja Advate püsiinfusiooni ajal tekkis ühel patsiendil VIII faktori taseme ootamatu langus.® edasi 10-14 päeva pärast operatsiooni. Sel perioodil säilis hemostaas. Plasma VIII faktori tase ja kliirens normaliseerusid 15. operatsioonijärgsel päeval. VIII faktori inhibiitorite testid, pideva infusiooni lõpus ja uuringu lõpus, andis negatiivseid tulemusi.
kuni Teave selle kõrvaltoime kohta on toodud allpool..
Üksikute kõrvaltoimete kirjeldus
VIII faktori inhibiitorite tekkimine
Adveiti immunogeensus® on uuritud kliinilistes uuringutes, mis hõlmasid 233 patsientidel (lapsed ja täiskasvanud) raske hemofiiliaga A (VIII faktori tase ≤1%) eelnevalt VIII faktori kontsentraatidega töödeldud (Mitte vähem kui 150 päeva jooksul täiskasvanutel ja lastel vanuses ≥6 aastat ja vähemalt 50 päevast manustamist lastele, kes on nooremad kui 6 aastat). Üks patsient pärast 26 Adveiti manustamise päevad® täheldati madala tiitriga inhibiitorite ilmumist (2.4 Bethesda ühikud [BE] põhineb modifitseeritud Bethesda testil). Pärast patsiendi uuringus osalemise lõpetamist inhibiitoreid ei tuvastatud..
Advate kasutamise keskmine kestus® kõigis kliinilistes uuringutes varem ravitud patsientidel oli 97 päeva (alates pühkima 1 kuni 709 päeva tutvustamist). Inhibiitorite üldine esinemissagedus (sama kõrge, ja madal tiiter) tehtud 0.4% (sisse 1 pärit 233 patsientidel).
Lõppenud kontrollimata kliinilises uuringus 060103, sisse 16 pärit 45 (35.6%) varem ravimata raske hemofiilia A patsiendid (VIII faktori tase ≤1%), kes said Adveiti® vähemalt 25 taotlemise päevad, VIII faktori inhibiitorid. Sisse 7 (15.6%) patsientidel oli kõrge inhibiitorite tiiter ja 9 (20%) patsientidel – inhibiitorite madal tiiter (sealhulgas üks patsient, mille puhul inhibiitorite teke klassifitseeriti mööduvaks).
Selle uuringu inhibiitorite tekke riskitegurid olid: mitte-kaukaasia rahvus, VIII faktori inhibiitorite perekonna ajalugu ja intensiivne ravi Advate suurte annustega® esimene 20 päeva tutvustamist. Sisse 20 patsientidel, need, kellel ei olnud loetletud riskitegureid, inhibiitorite ilmumist ei täheldatud.
Andmed saadi immuuntolerantsuse esilekutsumise kohta (IIT) varem ravimata patsientidel, patsientidel, milles ravimi Adveit kasutamisel® On tuvastatud VIII faktori inhibiitorid. Alamuuringu käigus uuringu raames 060103 patsientidega, varem ravimata, IIT-ravi on dokumenteeritud aastal 11 patsientidel, varem ravimata. Sisse 30 IIT-ga patsiendid (uurimistöö 060703) viidi läbi haiguslugude retrospektiivne analüüs. Andmete kogumine IIT patsientide registri jaoks on pooleli.
Uuring 060201 aastal viidi läbi kahe pikaajalise profülaktilise ravi režiimi võrdlev analüüs 53 patsientidel, varem ravitud (RLP): annustamisgraafik, valitakse individuaalsete farmakokineetiliste parameetrite alusel (vahemikus 20 kuni 80 ME VIII faktor sisse lülitatud 1 kg kehamassi vahedega 72 ± 6 tööaeg; n = 23), ja standardne profülaktiline annustamisrežiim (pärit 20 kuni 40 RÜ/kg iga 48 ± 6 ei; n = 30). Annustamisrežiimi eesmärk, valitakse individuaalsete farmakokineetiliste parameetrite alusel (ja arvutatakse spetsiaalse valemiga), 72-tunniste intervallidega süstide vahel. Selle uuringu andmed tõestavad, et mõlemad profülaktilised annustamisrežiimid on veritsussageduse vähenemise poolest võrreldavad.
kõrvaltoimed, seotud ainetega, kasutatakse tootmisprotsessis
Pärit 229 patsientidel, kes said ravi Adveitiga® ja uuriti hiina hamstri munasarjarakkude valkude vastaste antikehade olemasolu suhtes (SNO), sisse 3 patsientidel ilmnes statistiliselt oluline antikehade tiitri tõus, sisse 4 patsientidel ilmnesid antikehade tiitri püsivad piigid või mööduvad tõusud, ja ühel patsiendil märgiti, et, ja muud. Kõigi nende antikehade tiitrite muutustega ei kaasnenud kliinilisi ilminguid..
Nendest 229 ravitud patsiendid, kes said ravi Adveitiga® ja neid uuriti hiire immunoglobuliini G vastaste antikehade suhtes (IgG), sisse 10 patsientidel ilmnes statistiliselt oluline antikehade tiitri tõus, sisse 2 patsientidel tuvastati antikehade tiitri stabiilsed piigid või mööduvad tõusud ning ühel patsiendil ja seejärel, ja muud. Neli neist patsientidest, on teatatud üksikutest urtikaaria juhtudest, sügelus, lööve, eosinofiilide arvu mõningane tõus (kõigile näidustatud patsientidele ravim Advate® süstitakse korduvalt).
Ülitundlikkus
Allergilise tüüpi reaktsioonid hõlmasid anafülaksia ja väljendusid pearinglusena, paresteesia, lööve, looded, näo turse, nõgestõbi ja sügelus.
Ravimi kasutamine lastel
Välja arvatud inhibiitorite moodustumine varem ravimata patsientidel ja kateetriga seotud tüsistused, kõrvaltoimete esinemissageduse erinevus puudub, igas vanuses patsientidel, ei ole kliinilistes uuringutes tuvastatud.
Arvatavatest kõrvaltoimetest teatamine
Teave arvatavate kõrvaltoimete kohta võimaldab teil pidevalt jälgida ravimi Adveit kasulikkuse ja riski suhet®. Arstid, kasutades ravimit Adveit® A-hemofiiliaga patsientide raviks, peaks teatama arvatavatest kõrvaltoimetest, välja töötatud perioodil pärast ravimi registreerimistunnistuse väljastamist, standardmenetluse kohaselt riiklikele ravimiohutuse järelevalve asutustele.
Adveit: kasutamise vastunäidustused
- teadaolev ülitundlikkus toimeaine või ravimi ükskõik millise abiaine suhtes, samuti hiirte/hamstrite valkudele.
Adveit: kasutada raseduse ja imetamise ajal
Ravimi Adveit mõju® loomade reproduktiivfunktsiooni kohta ei ole uuritud. Sest, et hemofiilia A esineb naistel üliharva, ravimi Adveit ohutus® rasedatel ja rinnaga toitvatel naistel ei ole kindlaks tehtud. Enne Adveiti väljakirjutamist® raseduse ja imetamise ajal peab arst hoolikalt kaaluma võimalikke riske ja oodatavat kasu iga patsiendi puhul.
Adveit: Special juhiseid
Ülitundlikkusreaktsioonid
Valgupreparaatide sisselülitamisel / sisseviimisel on võimalik allergiliste reaktsioonide teke.. Ettevalmistus Adveit® on valk, ning sisaldab ka vähesel määral hiire- ja hamstrivalke.
Ravimi Advate kasutamisel® Teatatud on allergilist tüüpi ülitundlikkusreaktsioonidest, sh anafülaksia. Patsiente tuleb teavitada kohese ülitundlikkusreaktsiooni varajastest nähtudest., nagu nõgestõbi, sügelema, generaliseerunud villiline lööve, angioödeem, hüpotoonia (millega kaasneb pearinglus ja minestamine), šokk ja äge hingamispuudulikkus (rinnus, ähkimine). Patsiente tuleb teavitada nende sümptomite ilmnemisel, et nad lõpetaksid kohe ravimi kasutamise ja pöörduksid oma arsti poole.. Šoki korral tuleks rakendada üldtunnustatud šokivastaseid meetmeid..
VIII faktori inhibiitorite moodustumine
VIII faktori neutraliseerivate antikehade tekkimine (inhibiitorid) on teadaolev tüsistus hemofiilia A-ga patsientide ravimisel, mis kliiniliselt väljendub VIII faktori ravimi prokoagulandi aktiivsuse vähenemises. Inhibiitorid on klassi G immunoglobuliinid. Inhibiitorite tiitrit mõõdetakse Bethesda ühikutes. (BE) 1 ml plasma kohta, kasutades modifitseeritud Bethesda meetodit.
VIII faktori inhibiitorite ilmnemisel võib patsientidel tekkida Advate ebapiisav kliiniline vastus.®. Sellisel juhul on soovitatav pöörduda spetsialiseeritud hemofiilia ravikeskuse poole.. Inhibiitorite tekkerisk korreleerub VIII faktori ravimi kasutamise kestusega. (risk on kõige suurem esimesel 20 päeva tutvustamist), samuti geneetilised ja keskkonnategurid. Harva võivad inhibiitorid ilmneda pärast esimest 100 päeva tutvustamist.
On esinenud inhibiitorite taastekke juhtumeid (madala tiitriga) varem ravitud patsientidel, kellel on anamneesis inhibiitorid, (raviti rohkem kui 100 päeva tutvustamist) pärast patsiendi üleminekut ühelt VIII faktori ravimilt teisele. Seetõttu tuleb pärast üleminekut ühelt VIII faktori ravimilt teisele ravile pidevalt jälgida. (kui kliiniline, samuti labor) patsientide jaoks, ravitakse VIII faktori ravimiga, inhibiitorite varajaseks avastamiseks.
Üldiselt, patsientide jaoks, ravitakse VIII hüübimisfaktori ravimitega, tuleb hoolikalt jälgida inhibiitorite esinemise suhtes sobiva kliinilise vaatluse ja laboratoorsete testide abil. Kui VIII faktori plasmaaktiivsuse oodatud taset ei saavutata, või kui piisav annus ei suuda verejooksu ohjeldada, VIII faktori inhibiitorite tuvastamiseks tuleb teha sobiv analüüs. Ravi ei pruugi olla efektiivne patsientidel, kellel on kõrge VIII faktori inhibiitorite tase, tuleks kaaluda alternatiivsete ravimeetodite kasutamist. Neid patsiente peab ravima arst., kogenud hemofiilia ravis VIII faktori inhibiitorite juuresolekul.
Ennetav ravi Adveitiga® individuaalse annuse valikuga
VIII faktori algtaseme hoidmiseks ≥1% annuste intervalliga, komponent 72 ei, Advate ühekordne annus® Arst võib individuaalselt valida, võttes arvesse individuaalsete farmakokineetiliste parameetrite väärtusi. Kliinilises uuringus näidati, et profülaktiline annustamisrežiim 20-40 RÜ/kg iga 48±6 h järel on raviskeemiga sarnase kliinilise efektiivsusega 20-80 ME / kg intervalliga 72 ± 6 h, verejooksude esinemissageduse oluline vähenemine profülaktilise raviga võrreldes tellitava raviga.
Standardne profülaktiline režiim ravimi manustamisega ülepäeviti ja individuaalse profülaktilise ravi skeem, mille annus valitakse sõltuvalt farmakokineetilistest parameetritest ja ravimi manustamisega igal kolmandal päeval, on võrreldava efektiivsusega..
Kateetri kasutamisega seotud tüsistused ravi ajal
Kui on vaja tsentraalset veenipääsu seadet, siis on oht kateetriga seotud tüsistuste tekkeks, nagu lokaalne infektsioon, baktereemiata, tromboos kateetri asukohas.
teave, abiainete osas
Pärast lahustamist sisaldab ravimlahus 0.45 mmol naatriumi (10 mg) viaali kohta. Uimastite patsientidele nimetamisel tuleks arvesse võtta, need, kes järgivad naatriumisisaldusega dieeti.
Kasutamine Pediatrics
Loetletud erihoiatused ja ettevaatusabinõud kehtivad lastele., samas ulatuses, sama ka täiskasvanutele.
Erijuhised ladustamiseks ja kasutamiseks
Mikrobioloogilise saastumise võimaluse välistamiseks, ravim tuleb manustada kohe pärast lahuse valmistamist. Siiski on see tõestatud, et Adveiti valmistatud lahus® keemiliselt ja füüsikaliselt stabiilne aja jooksul 3 h 25°C juures.
Kõlblikkusaja jooksul võib ravimit hoida toatemperatuuril (temperatuuril kuni 25 ° C) mitte rohkem 6 kuud. Ravimi toatemperatuuril säilitamise algus- ja lõppkuupäev tuleb märkida ravimi pakendile.. Pärast toatemperatuuril hoidmist ärge pange ravimit edasiseks säilitamiseks külmikusse..
Soovitatav iga Adveiti manustamisega® registreerige meditsiinilistesse dokumentidesse ravimi nimetus ja partii number, et oleks võimalik luua seos patsiendi ja ravimipartii vahel.
Mõju sõidukite ja mehhanismide juhtimise võimele
Ettevalmistus Adveit® ei mõjuta autojuhtimise ja mehhanismidega töötamise võimet.
Adveit: üleannustamine
Rekombinantsete VIII hüübimisfaktori preparaatide üleannustamisest ei ole teatatud.. Üleannustamise sümptomid ei ole teada.
Adveit: ravimite koostoime
Adveit® koostoimeuuringuid teiste ravimitega ei ole läbi viidud..
Adveit: Adveit® säilitustingimused
Valguse eest kaitstult tuleb ravimit hoida pappkarbis., lastele kättesaamatus kohas temperatuuril 2 ° C kuni 8 ° C; Mitte külmutada.
Adveit: Adveit® säilivusaeg
Säilitusaeg – 2 aasta. Ärge kasutage pärast aegumiskuupäeva.
Adveit: rakendamise tingimused
Ravim on välja antud retsepti.
