Pharmakokinetischen Wechselwirkungen und allgemeinen Konzepte der Gleichwertigkeit und der Bioverfügbarkeit von Medikamenten
Entwicklung gemeinsamer Ansätze in bestimmten Pharmakotherapie Drogen, berücksichtigt werden, daß unterschiedliche Arten von Dosierungsformen haben unterschiedliche Bioverfügbarkeit. Wenn Aufnahme Arzneistoffs hängt im Wesentlichen von seiner physikalisch-chemischen Eigenschaften, die Bioverfügbarkeit - weitgehend von den Eigenschaften der Formulierung. Im Zusammenhang mit dieser wichtige klinische Bedeutung ist das Konzept der Äquivalenz und der Bioverfügbarkeit von Arzneimitteln.
Pharmazeutisch (Chemikalie) Gleichwertigkeit Medizin Mittel, sie die gleiche Menge des Wirkstoffs enthalten und entsprechen den geltenden Normen, während ihre inaktive Bestandteile können variieren.
Das Konzept der Bioäquivalenz Er bezieht sich auf eine chemisch äquivalente Präparate, die, wenn sie einem Patienten bei den gleichen Dosen und auf dem gleichen Schema in Blut und Gewebe des Wirkstoffs verabreicht sammelt sich in identischen Konzentrationen.
Das Konzept der therapeutische Äquivalenz Er bezieht sich auf Medikamente, die, wenn sie einem Patienten in gleichen Dosen und dasselbe Muster aufweisen Wesentlichen derselben therapeutischen Wirksamkeit oder Toxizität verabreicht; während diese Medikamente nebioekvivalentnymi sein.
Die Idee der Wirksamkeit des Medikaments immer mit ihm verbunden worden Bioverfügbarkeit. Quantitatives Merkmal, Bestimmung der Bioverfügbarkeit von Arzneimitteln (definitions FDA), ist die Rate und das Ausmaß der Akkumulation von Arzneimittel an ihren beabsichtigten Aktion. Allerdings, um Gewebeproben zu erhalten, und untersuchen sie für Arzneimittelgehalt in Experiment unmöglich. Daher die Bioverfügbarkeit des Arzneistoffes wird durch seine Konzentration im Blut beurteilt. In der Praxis bestimmen die absolute und relative Bioverfügbarkeit.
Absolute Bioverfügbarkeit Es ist die Haltung (in %) die Menge der Droge hat tiefe gewachsen, in einer oralen Dosierungsform verabreicht oder anderer, der Anzahl der vsosavshegosya
gleiche Substanz, im gleichen Dosis, aber als eine intravenöse Infusion oder Injektion, Bereitstellen 100% Bioverfügbarkeit.
Relativen Bioverfügbarkeit des Arzneimittels Es kann durch Vergleichen der Fläche unter der Konzentrations-Zeit-Kurve gemessen werden, Charakterisierung der Konzentration der Substanz im Serum beider Arzneimittel in der identischen Art der Verabreichung, wie oralen oder rektalen. Bioverfügbarkeit wird durch die Konzentration des Arzneimittels im Blut oder Urin beurteilt, wenn der Stoff in unverändertem Zustand ausgeschieden.
Wenn Medikamente die gleiche Bioverfügbarkeit in identischen Bedingungen, sie gelten als bioäquivalent.
Nach der FDA, Zubereitungen können bioäquivalent sein, trotz der Unterschiede in der Geschwindigkeit und dem Ausmaß der Absorption (Wenn die Absorptionsrate ist nicht kritisch Charakteristik, die wirksame Konzentration der aktiven Substanz im Körper zu erreichen, oder ist unwichtig für die Manifestation der therapeutischen Wirkung des Arzneimittels). In einigen Fällen kann die Absorptionsrate des Wirkstoffs von Arzneimitteln, die Wirksamkeit der Behandlung beeinflussen. Eine Seite, mit langsamen Absorption Stoffkonzentration im Blut kann unter dem Mindest therapeutisch sein, das bedeutet den gewünschten therapeutischen Effekt nicht liefern, und andererseits - bei zu schnellen Absorption, kann stark die Schwelle der zulässigen Konzentration überschreitet, verursacht unerwünschte Nebenwirkungen, oder toxischen. Daher Drogen, gekennzeichnet durch eine geringe Differenz zwischen den minimalen effektiven und maximal tolerierten Dosen der Substanz, werden, wenn bioäquivalent, und wenn der Grad der, und die Geschwindigkeit des Saug identisch sind.
Das Problem ist besonders akut Bioverfügbarkeit, wenn die Arzneimittel zur oralen Verabreichung bestimmt. Vom Standpunkt der Clinical Pharmacy wichtiger Unterschied in der Bioverfügbarkeit von Substanzen aus verschiedenen Arten von Dosierungsformen. Seine Definition wird durch die Unfähigkeit behindert, alle individuellen Eigenschaften des Patienten und den unterschiedlichen Eigenschaften der Dosierungsformen zu berücksichtigen. Bei oraler Einnahme der Arzneimittelzubereitungen, bevor es in den systemischen Kreislauf erreicht,, Es durchläuft eine Anzahl von Übergängen und Bestimmungsort erreicht weniger, was eine geringe Bioverfügbarkeit (zB, Noradrenalin, Testosteron, Phenacetin et al.). Die Gründe für die geringe Bioverfügbarkeit der Substanz kann während seines Aufenthaltes im Verdauungstrakt nicht ausreichend sein, sowie Alter, Sex und genetisch bedingten Unterschiede, verschiedene aktive Patienten, die Anwesenheit von Stresssituationen, das Vorhandensein bestimmter Krankheiten usw.. d. Bioverfügbarkeit abnimmt Stoffe und unter der Einwirkung von mehreren Faktoren, Auswirkungen auf seine Absorption.
Besondere Probleme entstehen, wenn eine Langzeittherapie, Wenn der Patient, ist eine Art von Dosierungsform angepaßt, zum anderen übertragen, Nichtäquivalenten. In diesem Fall kann die Wirksamkeit der Therapie zu reduzieren, Toxische Effekte auftreten. Solche Fälle sind bekannt, bei einem Wechsel Drogen Digoxin, Phenytoin, usw..
Manchmal ist es möglich, die therapeutische Äquivalenz von Medikamenten zu erzielen, Trotz der Unterschiede in deren Bioverfügbarkeit. Zum Beispiel, der Unterschied zwischen therapeutischen und toxischen Konzentrationen an Penicillin Hoch, daher Schwankungen seiner Konzentration im Blut, aufgrund unterschiedlicher Bioverfügbarkeit von Arzneimitteln, können deren therapeutische Wirksamkeit oder Sicherheit nicht erheblich beeinträchtigen. Gegenteil, für Arzneistoffe mit einem relativ kleinen Unterschied zwischen den therapeutischen und den toxischen Konzentrationsdifferenz der Bioverfügbarkeit ist wichtig,.
Da die therapeutische Wirkung, die Dauer und Intensität Zeitabhängigkeit wird durch die Wirkstoffkonzentration im Blutplasma verursacht, Regel betrachten drei Optionen - die maximale Konzentration einer Substanz im Blut, die Zeit, um zu erreichen, und die Fläche unter der Kurve, was zu den Koordinaten des Konzentrations-Zeit-.
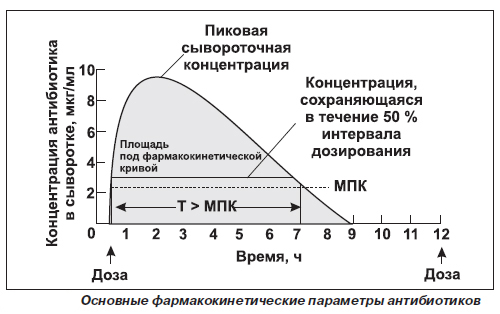
Die Abbildung zeigt, dass die Konzentration der Substanz im Blut erhöht die Geschwindigkeit und das Ausmaß ihrer Absorptionsmaxima und, wenn die Geschwindigkeit des Materials aus dem Körper, die der Geschwindigkeit der Absorption wird. Die langsamere Resorption der Substanz, die später erreichte seine maximale Konzentration.
Jedoch kann eine Schätzung Bioverfügbarkeit auf Basis von Daten der maximalen Wirkstoffkonzentration in Blut nicht ausreichend genau sein,, Da der Erhalt der Substanz in den systemischen Kreislauf beginnt seine Eliminierung. Die Zeit bis zur maximalen Konzentration zu erreichen, hängt von der Rate der Absorptionsmittel und ein Indikator für die Geschwindigkeit. Die wichtigste Maßnahme ist die Fläche unter der Kurve der Konzentration Bioverfügbarkeit (PKK) von Zeit. Er ist direkt proportional zu dem Gesamtgehalt der unveränderten Substanz im Blutplasma. Um festzustellen, die PKK durchgeführt Blutentnahme zur völligen Abschaffung eines Stoffes. Zwei Arzneimittel, identische Kurven Geschwindigkeit und das Ausmaß der Absorption kann als bioäquivalent sein. Wenn Medikamente die gleiche PAC, unterscheiden sich jedoch in der Form der Kurven der Konzentration gegen die Zeit, sie werden als gleichwertig in das Ausmaß der Resorption, unterscheiden sich jedoch in ihrer Geschwindigkeit.
Bestimmung der Bioverfügbarkeit wiederholte Verabreichung des Medikaments ist bevorzugt. PAC ist in eines der Intervalle zwischen zwei aufeinanderfolgenden Verabreichungen gemessen. Genauere Ergebnisse werden bei der Bestimmung der Bioverfügbarkeit innerhalb weniger Tage gemittelt. Wenn das Arzneimittel in den Urin ausgeschieden (vor allem in unveränderter Form), die Bioverfügbarkeit beurteilt werden kann, Bestimmung der Gesamtmenge für die Zeit, gleich 7-10 Halbwertszeit der Substanz. Eine genauere Definition der Bioverfügbarkeit kann die Untersuchung von Blut und Urin zur gleichen Zeit.
So, Bioverfügbarkeit und Bioäquivalenz sind die wichtigsten Indikatoren für die Qualität von Arzneimitteln in der Charakterisierung ihrer Therapiemöglichkeiten.
