Mechanismus účinku léků
Ve většině případů,, Léčivá látka (ligand) To mělo jeho účinek, musí splňovat určité součásti těla - cílové receptory, molecular structure, zastupování jsou bílkoviny, méně často nukleové kyseliny, lipidové nebo jiné konfigurace, umístěné uvnitř nebo na povrchu buněk, se kterým interaguje, spuštění řetězce biochemických a fyzikálně-chemických procesů, vedoucí k určitému efektu.
Existují dva typy membránových receptorů – iontové kanály a receptory, spojené s G-proteinem. Například, Adethylcholin a podobné léčivé látky se vyznačují sodíkovým kanálem. Acetylcholin interaguje s kanálovým proteinem, způsobující v něm konformační změny, které přispívají k otevření kanálu a pronikání sodných iontů do buňky. Tento proces je základem nervového vzrušení.. Některé léky, interakce s proteinem sodíkového kanálu, zabránit jeho otevření, tím blokuje přenos nervového vzruchu.
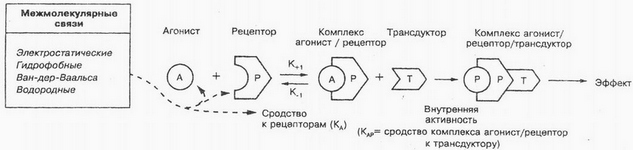
Na vnitřní část plazmatické membrány buněk se váže tzv. G-protein, který zajišťuje synchronizaci procesu lékové interakce se současnou aktivací odpovídajících intracelulárních cílových proteinů. Jak je znázorněno na obrázku, molekula léčiva interaguje s receptorem (P) na vnějším povrchu membrány, což způsobuje konformační změny v receptorovém proteinu. Díky tomu G-protein mění svou prostorovou strukturu., migruje v membránové rovině k enzymům, které jsou uvnitř buňky neaktivní. Interakce G-proteinu s enzymy (T) způsobí jejich aktivaci (LV/R/T). Noradrenalin, dopamin a další ligandy specificky interagují s receptory, spojené s G-proteinem. Je třeba poznamenat, že acetylcholin může interagovat nejen s kanálovým proteinem, ale také s receptory, spojené s G-proteinem.
Aby došlo k interakci mezi ligandem a bioreceptorem, je to nezbytné, aby byly komplementární, to znamená, že mezi nimi musí být určitá spřízněnost, nebo afinita (přizpůsobení velikosti, prostorová konfigurace, přítomnost opačných nábojů atd.. d.). Například, kladný náboj exogenního ligandu musí odpovídat zápornému náboji receptoru, a nepolární radikály látky se mohou vázat na hydrofobní oblasti receptoru.
Mezi fyzikálně-chemické vlastnosti léčivých látek, ovlivňující jejich interakci s receptory, měla by být zvýrazněna velikost molekuly, podle toho, která látka může interagovat s celým receptorem nebo s jeho složkou. Kinetika jeho průniku biologickými membránami závisí také na velikosti molekuly léčiva.. Obvykle se zvětšováním velikosti molekuly roste její flexibilita a možnost tvorby van der Waalsových vazeb s makromolekulárním partnerem.. Kromě, důležitá je stereochemie molekuly léčiva. Z, v jaké izomerní formě se droga nachází, jeho farmakologická aktivita závisí. A je potřeba mít na paměti: tím těsnější je konformace molekuly receptoru, tím silnější je rozdíl v působení stereoizomerů.
Interakce lék-receptor se provádí díky mezimolekulárním vazbám. Nejprve je látka přitahována k receptoru pomocí elektrostatických sil., a v přítomnosti komplementarity tvoří vazby s receptorem pomocí fyzikálních a fyzikálně-chemických interakcí (typické pro léčivé látky, které se z těla vylučují v nezměněné nebo mírně pozměněné formě) nebo chemické interakce (inherentní ve spojeních, které v těle procházejí chemickými přeměnami). Nejslabší van der Waalsovy síly se podílejí na stanovení specifičnosti interakce léku s biochemickými reaktivními systémy. Vodíkové vazby se účastní procesů rozpoznávání a fixace látky. (ligand) k biostrukturám. V těchto případech vznikají iontové vazby, když léčivé látky obsahují kationtovou nebo aniontovou skupinu, a opačné struktury jsou v bioreceptorech. Často se iontové vazby tvoří v prvních krocích farmakologické reakce mezi látkami a receptory.. V takových případech je účinek léku reverzibilní.. Důležitá je tvorba koordinačních kovalentních vazeb.. Za jejich účasti dochází k interakci alkylačních činidel s biosubstráty., stejně jako léky a antidota s kovy při tvorbě stabilních chelátových komplexů, např, unitiol s arsenem nebo tetacin-kalcium s olovem. Působení takových látek je nevratné..
Kromě, dochází k hydrofobní interakci. I když energie jeho vazeb je malá, interakce velkého množství dlouhých alifatických řetězců vede ke vzniku stabilních systémů. Hydrofobní interakce hrají roli při stabilizaci konformací biopolymerů a tvorbě biologických membrán..
Aminokyselinové zbytky v molekule proteinového receptoru obsahují polární a nepolární skupiny, které určují vznik polárních a nepolárních vazeb mezi nimi a léčivými látkami. Polární skupiny (-ACH, -NH, VRKAT-, -N3H, =O) poskytovat vzdělání, hlavně, iontové a vodíkové vazby. Nepolární skupiny (vodík, methyl, cyklické radikály atd.) tvoří hydrofobní vazby s léky s nízkou molekulovou hmotností.
Tak, interakce léků se specifickými receptory může být provedena díky různým chemickým vazbám, mající nestejnou sílu. Tak, přibližná síla kurariformních látek s cholinergními receptory pro elektrostatiku (iontový) interakce je 5 kcal / mol, iontový dipól - 2-5 kcal / mol, dipól-dipól - 1-3 kcal / mol, Vodíkové vazby - 2-5 kcal / mol, van der Waalsovy dluhopisy - 0,5 kcal / mol, hydrofobní vazby - 0,7 kcal na jeden CH2-skupina. Pokles pevnosti vazby v závislosti na vzdálenosti mezi atomy pro elektrostatickou interakci je r-2, iontový dipól - r-3, dipól-dipól - r-4, vodíkové vazby - r-4, van der Waals dluhopisy - r-7. Tento druh spojení lze přerušit., který zajišťuje vratnost působení léčivých látek. Kovalentní vazby jsou silnější, které zajišťují dlouhodobé a často nevratné působení látek, např, alkylační protirakovinné léky. Většina léků se váže na receptory reverzibilně. V čem, obvykle, povaha spojení je velmi složitá: současně iontové, dipól-dipól, van der waals, hydrofobní a jiné typy komunikace, která je do značné míry určena komplementaritou látky a receptoru a, příslušně, stupeň jejich konvergence.
Vazebná síla látky s receptory se označuje termínem „afinita“. Látky, působí na stejné receptory, mohou k nim mít různé stupně afinity. V tomto případě mohou látky s vyšší afinitou vytěsnit látky s nižší afinitou ze spojení s receptory.. K určení rovnovážného stavu mezi "obsazenými" receptory (DR), volné receptory a volná látka (D) používá se disociační konstanta (KD), který je určen následujícím vzorcem:
KD=[D]*[R]/[ DR]
Záporný logaritmus KD (pRD) je indikátorem afinity. K charakterizaci afinity se často používá pD index.2, T. to je. záporný logaritmus EC50, (koncentrace látky, ve kterém působí efekt, složka 50% od maximálního účinku).
Rozmanitost chemických vazeb interakce a jejich nestejná síla, nebo afinita mezi ligandy a bioreceptory se vysvětluje složitou strukturou léčivých látek, obsahující radikály různé reaktivity a mající vícerozměrnou objemovou formu, stejně jako složitost procesů interakce, často probíhá v několika fázích (fáze): tvorba komplexu lék-receptor; intramolekulární seskupení; disociace komplexu.
Tak, farmakologický účinek mohou vyvolat pouze látky s výraznou afinitou k bioreceptoru. Závažnost účinku závisí na koncentraci léčiva a celkovém počtu receptorů..
Pokud mají látky dostatečnou vnitřní aktivitu, pak se nazývají agonisté. Vnitřní aktivita je chápána jako schopnost agonistů vyvolat biologický účinek změnou konformace receptorů, T. to je. schopnost ligandu aktivovat receptor. Tento jev je považován za afinitu komplexu agonista-receptor k měniči, přeměna vnějších signálů na vnitřní se nazývá transdukce. Základem takových procesů je intracelulární přenos signálu, jako kontrakce svalových vláken, buněčné dělení, proliferace, diferenciace atd.. To je nyní stanovena, co do mnoha látek (hormony, bioaktivní peptidy, nukleotidy, steroidy, nízkomolekulární bioregulátory atd.) buňka má specifické receptory. V důsledku interakce těchto látek s těmito specifickými receptory se tvoří sekundární poslové (zprostředkovatelů), které spouští kaskádu biochemických reakcí.
Existuje koncept"částečné agonisty"- léčivé látky, že, vazba na receptory, neposkytují maximální účinek. Tento nepochopitelný jev je údajně způsoben neúplným (na) závislost afinity komplexního léčivo - receptor pro převodník. Například, částečný agonista opiátových receptorů nalorfin působí podobně jako úplný agonista těchto opiátových receptorů morfin, i když slabší než ten druhý. Současně při společném použití nalorfin oslabuje nebo eliminuje účinky morfia; zejména, inhibiční účinek morfinu na dýchání je eliminován. Isoprenalin je skutečný agonista, a prenalterol je částečný agonista pro β-adrenergní receptory. Podle teorie receptoru, pravý agonista může vyvolat maximální odpověď, i když interaguje pouze s částí receptorů.
Specifické receptory mohou mít stejná nebo různá vazebná místa pro agonisty a antagonisty. Pro různé agonisty jsou možná různá vazebná místa. V tom případě, když agonista a antagonista mají stejná vazebná místa a blokující účinek antagonisty na receptor je zcela eliminován zvýšením koncentrace agonisty (je dosaženo maximálního agonistického účinku), vztah mezi antagonistou a agonistou se označuje jako kompetitivní antagonismus. Pokud jsou vazebná místa pro agonistu a antagonistu různá, pak je vztah mezi nimi definován jako nekonkurenční antagonismus. K charakterizaci antagonistů se často používá index pA.2 (záporný logaritmus molární koncentrace antagonisty, pro dosažení standardního účinku agonisty musí být jeho koncentrace zdvojnásobena).
V podmínkách celého organismu způsobují agonisté a antagonisté změny určitých fyziologických funkcí.. Působení antagonistů je v tomto případě určeno skutečností, že zabraňují účinku odpovídajících přirozených ligandů na specifické receptory (např, antagonista M-cholinergních receptorů atropin interferuje s účinkem jejich agonisty acetylcholinu). Změny, které přímo souvisejí s interakcí látek se specifickými receptory, označují termínem „primární farmakologická reakce, což může být začátkem celé řady reakcí, vedoucí ke stimulaci nebo potlačení určitých fyziologických funkcí“.
Změny funkcí orgánů nebo systémů (např, změny síly a srdeční frekvence, tonus hladkého svalstva vnitřních orgánů, sekrece žláz, BP a další.), vyvolané léky, označený jako farmakologické účinky této látky. Tak, u srdečních glykosidů je primární farmakologickou reakcí inhibice aktivity transportu Na +, K-ATP-áza vláken myokardu, který je považován za možný specifický receptor pro srdeční glykosidy. V tomto ohledu je narušen tok K + do svalových vláken a výstup Na + z vláken., zvyšuje se obsah Ca2 + v cytoplazmě, který podporuje interakci aktinu a myosinu. Výsledkem těchto změn je zvýšení síly srdečních kontrakcí., jaký je hlavní farmakologický účinek srdečních glykosidů.
Dlouhodobá expozice agonistů specifickým receptorům je často doprovázena snížením jejich citlivosti. Ten může být spojen se změnou receptorů, snížení jejich počtu (hustota) nebo narušení procesu, které následují po stimulaci receptoru. Současně se farmakologické účinky agonistů stávají méně výraznými..
Tak, farmakologické účinky většiny léčivých látek jsou spojeny s jejich účinkem na odpovídající specifické receptory.
Látky s vysokou afinitou k bioreceptoru a nízkou vnitřní aktivitou se nazývají antagonisté., nebo blokátory, Protože oni, aniž by došlo ke změnám v konformaci bioreceptorů, zabránit interakci endogenních a/nebo exogenních agonistických ligandů s ním. Existují také takzvané „sekundární neboli němé receptory, se kterými se váží léčivé látky, ale nemají žádný farmakologický účinek. Tyto „mute“ receptory jsou nejčastěji přítomny v bílkovinách a krevní plazmě. (ale lze je nalézt i v tkáních). Spojení s „němými“ receptory vede ke snížení koncentrace volného léčiva, a tím ke snížení terapeutického účinku.
Četné moderní teorie, vysvětlující mechanismus interakce ligand-receptor, stav samotných receptorů, nedostatek úměrnosti mezi počtem obsazených receptorů a konečnou odpovědí, změna účinnosti přenosu signálu a existence rezervních receptorů a částečných agonistů atp.. d. tvořily základ představ o mechanismu účinku zástupců různých skupin léčivých látek. Tyto interakce se dále dělí na interakce receptorů a chemické interakce..
Mechanismus interakce léčivých látek s bioreceptorem lze znázornit jako následující schéma: každý ligand (lék nebo fyziologický substrát) se váže na specifické místo na specifickém receptoru. Aktivované receptory přímo nebo nepřímo regulují toky iontů (1) a/nebo jiné intracelulární procesy (sekrece nebo svalové kontrakce) nebo aktivuje proteinový systém vázající guanin-nukleotid (G-proteiny), co, podle pořadí, zvyšuje aktivaci enzymového systému druhého mediátoru. V cytoplazmě funguje několik různých druhých poslů, aktivace různých cílových proteinů, například protein- kináza. Ty působí na specifické substráty a zprostředkovávají farmakologický účinek..
Z uvedeného popisu je to vidět, že působení léčivých látek se uskutečňuje následujícími mechanismy:
- fyziologické funkce tkání (např, kontraktilní, sekreční) mohou být regulovány několika receptory, a tudíž, a různé ligandy;
- mezi interakcí léku s receptorem a reakcí tkáně nebo orgánu může existovat několik mezistupňů, zejména aktivace systémů druhého posla vázaného na receptor;
- účinnost mechanismů, odpovědný za sekvenci podnět-odpověď, a hustota receptoru se může lišit od tkáně ke tkáni.
Terapeutický účinek některých léčivých látek je způsoben jejich přímým (není spojen se specifickými receptory) chemická interakce s endogenními sloučeninami nebo jiné mechanismy interakce (osmolality, adsorpce). Tedy na osmotická diuretika – mannitol, močovina – neexistují žádné specifické receptory. Tyto látky zvyšují osmotický tlak v renálních tubulech., v důsledku toho je narušena reabsorpce vody a zvyšuje se výdej moči. Působení adsorpčních látek není spojeno se specifickými receptory, kyselinotvorná diuretika.
Antacida (např, hydroxidy hliníku nebo hořčíku) reagovat s kyselinou chlorovodíkovou za vzniku produktů s mírně kyselými vlastnostmi. Chelatační činidla, vazba s některými kovy, tvoří neaktivní chemické komplexy.
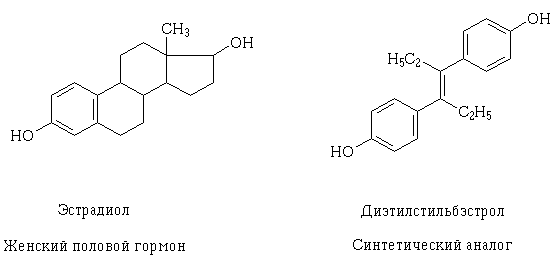
S prohlubováním znalostí o struktuře receptorů a mechanismu možné farmakodynamické interakce léčiv na buněčné úrovni bylo možné je cíleně vytvářet., a také vysvětlení, proč léčivé látky mohou mít podobný účinek, lišící se, na první pohled, její strukturu. Příkladem takového jevu je estradiol a trans izomer diethylstilbestrolu, syntetický analog ženských pohlavních orgánů.. Jejich strukturní molekuly jsou různé, ale obsahují funkční hydroxyskupiny stejných vlastností a velikostí, podobně umístěné a orientované v prostoru, díky čemuž mohou molekuly těchto látek interagovat se stejným receptorem a mít podobný farmakologický účinek.
Cesty, kterými léčivé látky vyvolávají určité farmakologické účinky, označovaný termínem "mechanismy působení". Tento koncept se používá k vysvětlení působení léků na molekulární, orgánové a systémové úrovni. Například, mechanismus účinku anticholinesterázových léků na molekulární úrovni je redukován na blokádu acetylcholinesterázy interakcí s jejími aniontovými a esterázovými centry. Ve stejnou dobu, vysvětlující mechanismus antihypertenzního účinku anticholinesterázových léků, indikují bradykardii a vazodilataci jako příčinu tohoto účinku, T. to je. zvážit mechanismus tohoto účinku na orgánové úrovni.
Výzkum mechanismů účinku léčivých látek pokračuje., navíc představy o mechanismu účinku konkrétní léčivé látky se při získávání nových údajů mohou nejen zpřesnit, ale také výrazně změnit.
