Koagulace hemostáze – Systém hemostáze
Srážení krve je komplexní enzymatický proces, který zahrnuje řadu proteolytických enzymů, stejně jako neenzymatické proteinové a fosfolipidové složky, prudce zrychlující a zesilující aktivaci a působení enzymů.
Obvykle lze proces srážení krve rozdělit do dvou hlavních fází:
- počáteční vícestupňová, což vede k aktivaci protrombinu (faktor II) s jeho přeměnou na aktivní enzym – trombin (IIa);
- finále, ve kterém se fibrinogen pod vlivem trombinu nejprve přemění na monomery a dimery fibrinu, a poté na fibrin-polymer, který je stabilizován aktivovaným faktorem XIII.
Podle mezinárodní nomenklatury, všechny koagulační faktory, Kromě – krevní destička, označeno římskými číslicemi (v tabulce).
Charakteristika faktorů krevního srážení | |||||
Digitální označení | Nejpřijímanější tituly | Obsah v krevní plazmě, g / l | Aktivita, % | Plazmatický poločas po intravenózním podání | Minimální úroveň, nezbytné pro hemostázu |
| Já | fibrinogen | 1.8-4.0 | – | 3—5 dní | 0,8 g / l |
| II | Protrombin | Na 0,1 | 80—120 | 3- 4 dny | 40% |
| III | Tkáňový tromboplastin | 0 | 0 | ? | – |
| IV | Vápenaté ionty | 0,9-1,2 mmol/l | – | – | – |
| PROTI | Ac-globulin (proakcelerin) | Na 0,01 | 70—150 | 18-24 | 10-15% |
| VII | Prokonvertin | " 0,005 | 80—120 | 4— 6 hod | 5-10% |
| VIII | Antihemofilní globulin (AGG)
| 0,01—0,02 | 60—250 | 12— 18 hodin | 30—35 % |
| IX | PTC faktor (Složka plazmatického tromboplastinu), Vánoční faktor | Na 0,003 | 70—130 | 20—30 hod | 20—30 % |
| X | Stewart-Prowerův faktor | " 0,01 | 80—120 | 48-56 hod | 10—20 % |
| XI | PTA faktor (Předchůdce plazmatického tromboplastinu), plazmatický prekurzor tromboplastinu | " 0,005 | 70—130 | 60 žádná | ? |
| XII | Faktor Hageman, kontaktní faktor | Na 0,03 | 70—150 | 2-3 dny | méně 1 % |
| XIII | Faktor stabilizující fibrin (fibrináza) | 0,01-0,02 | 70—130 | 2-3 dny | 2-5% |
| Plazmatický prekalikrein, Fletcherův faktor | Na 0,05 | 60—150 | ? | méně 1 % | |
| Vysokomolekulární kininogen (VMC), faktor ve Fitzgeraldu, Flojack faktor, Williamsův faktor | Na 0,06 | 80—130 | ? | méně 1 % | |
Abych to naznačil, že tyto faktory byly aktivovány, k symbolům číselných faktorů je přidáno písmeno „a“., a v tom případě; pokud se jeden z jeho fragmentů stane aktivním principem faktoru,- písmeno "f"
Kromě digitálního označení se pro koagulační faktory používají další názvy - podle jejich funkce (např, faktor VIII - antihemofilní globulin), poprvé podle příjmení pacientů: zjištěný nedostatek jednoho či druhého faktoru (faktor XII - Hagemanův faktor, faktor X - Stewart-Prowerův faktor a atd.), méně často - podle jmen autorů (např, von Willebrandův faktor).
Působí se proti srážení krve primární (nezávisle syntetizovány) a sekundární, vznikající při koagulaci a fibrinolýze fyziologické antikoagulancia.
Transformace fibrinogenu na fibrin
Je vhodné začít s úvahami o procesu srážení krve od jeho konečné fáze, spočívající v, co je proteolytický enzym trombin, vytvořený od svého neaktivního předchůdce - protrombin, štěpí čtyři peptidy z molekuly fibrinogenu (dva peptidy A a dva peptidy B), v důsledku čehož vznikají monomery fibrinu, z nichž každý má čtyři volné vazby. Spojováním monomerů těmito vazbami k sobě, nejprve ve dvojicích - do dimerů, a pak do polymerů (spojení end-to-end a side-to-side). vznikají fibrinová vlákna.
Fibrinogen je globulární glykoprotein (molekulová hmotnost 340000), skládající se ze dvou stejných podjednotek. Každá podjednotka se skládá ze tří řetězců - Aα, Bb a c.
Nejprve trombin odštěpí peptidy A z této molekuly (tvořící des-A-monomery fibrinu), pak - peptidy B (des-AB nebo kompletní fibrinové monomery). Vzhled volných peptidů A v cirkulující krvi (stanoveno imunologicky pomocí anti-A séra) slouží jako známka trombinémie a používá se jako „svědek“ intravaskulární koagulace (při DIC, masivní trombóza).
Fibrinové monomery mají trinodulární strukturu, a jejich spojení do polymeru prochází fázemi tvorby dimeru, z nichž při podélném a příčném spojení vznikají protofibrily, a pak fibrinová vlákna. Tento fibrin je rozpustný v 5-7 M . močovina nebo v 2 % kyselina monochloroctová, proto je označován jako fibrin S (rozpustný). Pod vlivem faktoru XIII, který je také aktivován trombinem v přítomnosti vápenatých iontů, ve fibrinu se tvoří další disulfidové vazby jak mezi γ-, a a-řetězce, co to dělá. nerozpustný v močovině – fibrin I (nerozpustný).
Už za normálních podmínek relativně mírné koncentrace trombinu (např, způsobující srážení krevní plazmy za 10-12 s) zajistit úplnou přeměnu fibrinogenu na fibrin, díky čemuž tento protein již není v krevním séru imunologickými a jinými metodami detekován.
Na rozdíl od tohoto, během procesů, vyznačující se intravaskulární koagulací, citlivost na trombin klesá a proces polymerace fibrinových monomerů je v té či oné míře narušen, díky čemuž se prodlužuje doba koagulace trombinu a výše uvedené prahové dávky trombinu již nesrážejí veškerý fibrinogen. Toto porušení je způsobeno skutečností, že některé úplné a neúplné monomery fibrinu tvoří komplexní sloučeniny s fibrinogenem a, pravděpodobně, s časnými produkty rozkladu fibrinu a fibrinogenu plasminem. Tyto velké molekulární a rozpustné komplexy fibrin-monomer se střední molekulovou hmotností (RFMK), v literatuře označovaný jako „špatně koagulující fibrin“, "blokovaný fibrinogen", špatně koagulují pod vlivem trombinu (mají relativní trombinovou rezistenci), ale po přidání do plazmy tvoří gel 50 % ethanol (etanolový test), některé vzorky protamin sulfátu, roztok β-naftolu v 50 % alkohol, kyselý ortofenanthrolin.
Fenomén neenzymatické koagulace RFMK (blokovaný fibrinogen) se nazývá parakoagulační fenomén a je široce používán v laboratorní diagnostice trombinémie a intravaskulární koagulace. Následující testy nám umožňují plně identifikovat tyto komplexy::
- koagulační test s jedem středoasijského hada efa;
- test s ortofenantrolinem;
- Zkouška adheze stafylokoků.
Tak, transformace fibrinogenu na fibrin může probíhat jako obvykle, a se vznikem RFMK (parakoagulační produkty), jejichž identifikace je důležitá pro diagnostiku intravaskulární koagulace.
Obecné posouzení konečné fáze koagulačního procesu provedené pomocí trombinového testu, T. to je. stanovením doby srážení citrátové plazmy, když je k ní přidáno standardní množství trombinu. Test má velký význam pro diagnostiku mnoha krvácivých poruch, jeho výsledky jsou důležité pro správnou interpretaci hodnot všech ostatních koagulačních testů, protože inhibice konečné fáze procesu prodlužuje koagulační dobu ve všech ostatních studiích.
Mechanismy transformace protrombinu na trombin
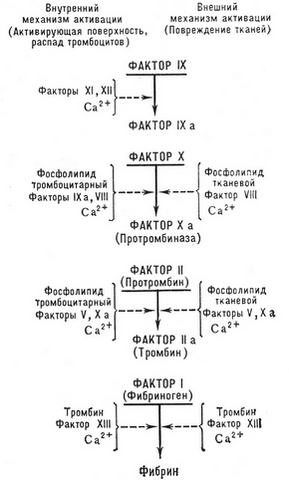
Podle moderní kaskádové komplexní teorie srážení krve, aktivace protrombinu (faktor II) je výsledkem vícestupňového enzymatického procesu, při kterém se postupně aktivují různé koagulační faktory a vzájemně se ovlivňují. Z nich faktory III, VII, X, IX, XII a XI, a prekalikrein jsou proteolytické enzymy, a faktory VIII, V - neenzymatické urychlovače procesu, mnohotisíckrát urychluje aktivaci enzymových faktorů.
Existují dva hlavní mechanismy pro spuštění procesu koagulace - vnější a vnitřní.
Externí koagulační mechanismus
Externí koagulační mechanismus spouštěné tkáňovým tromboplastinem, které se mohou dostat do krevní plazmy z poškozené (zranění, operace atd.) tkáně, stěny nádoby (produkované poškozeným endotelem za účasti aktivovaných krevních destiček), a také vstoupit do krevního řečiště s tkáňovým mokem (embolie plodové vody, peritoneálně-venózní bypass, různé druhy šoků). Tkáňový tromboplastin může být produkován přímo v krvi aktivovanými monocyty (pod vlivem endotoxinu, imunitní komplexy a t. d.).
Tkáňový tromboplastin je také produkován ve velkém množství buňkami některých maligních nádorů. (včetně leukemických).
Aktivní složkou tkáňového tromboplastinu je protein - apoprotein C, zatímco fosfolipidová část faktoru III je nespecifická a působí jako matrice aktivující proces (T. to je. funkčně podobný faktoru 3 Destiček, kefalin, erytrofosfatid).
Z diagramu koagulace krve je to vidět, že tkáňový tromboplastin tvoří komplex s ionty vápníku a faktorem VII, aktivuje poslední, což vede k tvorbě silného enzymového aktivátoru faktoru X.
V laboratorních podmínkách je vnější mechanismus simulován testem protrombinového času, při níž se k rekalcifikované citrátové plazmě zvenčí přidává tkáň (nejčastěji z lidského nebo králičího mozku) zaznamenává se tromboplastin o určité aktivitě a době srážení.
Vnitřní koagulační mechanismus
Vnitřní mechanismus je mnohem složitější a důležitější pro dešifrování patogeneze a diagnostiku nejčastější hemoragické diatézy v klinické praxi – hemofilie A a B, angiohemofilie, nebo von Willebrandova choroba (představují více 97 % všechny dědičné hemoragické koagulopatie).
S vnitřním mechanismem, srážení krve (plazma) realizované bez účasti tkáňového tromboplastinu.
Spouštěcím faktorem tohoto mechanismu je faktor XII (Hagemana), k jejichž aktivaci dochází v důsledku kontaktu s krví nebo s cizím povrchem (sklo, kov, kaolin atd.. d.), nebo se subendotelem (kolagen) a další složky pojivové tkáně, co se pozoruje při poškození stěn krevních cév (mechanická poranění, vaskulitida, ateroskleróza atd.. d.).
Kromě, faktor XII může být aktivován jeho enzymatickým štěpením (kalikrein, plasmin nebo jiné proteázy). Proto, jsou možné dva typy aktivace faktoru XII:
- a) kontakt - s tvorbou faktoru XIIa;
- na) enzymatické - s tvorbou aktivního fragmentu faktoru XII (XIII).
Mezi účinky faktorů XIIa existují určité kvalitativní rozdíly (má větší vliv na koagulaci) a XIII (má větší aktivační účinek na kalikrein-kininový systém a fibrinolýzu). Obecně je faktor XII univerzálním aktivátorem všech proteolytických systémů plazmy – koagulace, kalikrein kinin, fibrinolytické a komplementové systémy.
V počátečním (kontakt) nastává fáze koagulačního procesu, jedna strana, vzájemná aktivace faktoru XIIa a kalikreinu v komplexu faktor XII - prekalikrein - vysokomolekulární kininogen, a poté - aktivace faktoru XI v komplexu faktorů XIIa - XI - ICH.
Tato počáteční fáze je nejdelší (4/5 všechny koagulační čas), aktivuje se se zvětšující se plochou a dobou trvání kontaktu krve s cizím povrchem (minimální aktivace při silikonování nádobí a rychlejší výzkum po odběru krve ze žíly, maximálně - s přídavkem kaolinu). Je důležité vzít v úvahu, že kontaktní aktivace faktorů XII a XI nastává v krvi a plazmě stabilizované citrátem nebo oxalátem, T. to je. nevyžaduje ionty vápníku. Účast vápníku na srážení krve začíná až od okamžiku aktivace faktoru IX, T. to je. vytvoření dalšího komplexu 2.
Při vytváření maximálního kontaktu s kaolinem a dostatečného množství faktoru 3 krevní destičky nebo kefalin (T. to je. v aktivovaném parciálním tromboplastinovém testu) snížená aktivace faktoru XI a pomalejší koagulace mohou být způsobeny nedostatkem faktoru XII, XI. prekallikreina, vysokomolekulární kininogen (VMC). Deficit faktoru XI je nejčastější, jiné poruchy jsou pozorovány extrémně vzácně.
Mnohem častěji je porušení vnitřního koagulačního mechanismu spojeno s defektem v dalším stadiu - aktivace faktorů IX a VIII.. Obvykle, je to způsobeno nedostatkem složek faktoru VIII, T. to je. s hemofilií A a angiohemofilií nebo von Willebrandovou chorobou (o 93 % Všichni pacienti), méně často - s nedostatkem faktoru IX (hemofilie B).
Velký klinický význam faktoru VIII vyžaduje podrobnější zvážení údajů o jeho struktuře a funkci..
Podle aktuálních dat, faktor VIII je proteinový polymer, skládající se z řady identických podjednotek. Každá podjednotka obsahuje následující součásti:
1) koagulační část (VIII: FROM) a jeho antigen (VIII: SAG);
2) von Willebrandův faktor (FV) nebo ristomycinový kofaktor agregace krevních destiček (VIII: FV, VIII: PKOF) a jeho antigen (VIII: Kardiovaskulární, VIII: RAg / FV);
3) sacharidová část a, možná, další neidentifikovaný proteinový komponent.
Místo syntézy VIII:FROM neurčeno, tato syntéza je řízena gen, umístěné na X chromozomu; jeho izolované porušení je charakteristické pro hemofilii A.
Syntéza von Willebrandova faktoru (FV) řízena autosomálně a vyskytuje se téměř výhradně v endotelu, V důsledku toho se tento faktor používá jako marker endotelu; jeho hladina v krvi prudce stoupá u mnoha cévních onemocnění.
Deficit von Willebrandova faktoru nebo změna jeho multimerní struktury způsobuje narušení vaskulárně-destičkové hemostázy (prodloužené krvácení, zhoršená adheze krevních destiček ke sklu a agregace krevních destiček kolagenu nebo ristomycinu), a snížení koagulační aktivity VIII:FROM. Tyto poruchy v různých kombinacích jsou pozorovány u různých typů angiohemofilie. VWF je obsažen v krvi stejně jako v plazmě, a v krevních destičkách (v α-granulích), Navíc je uvnitř těchto buněk oddělen od VIII:FROM. U hemofilie A úrovně VIII:C prudce snížena, zatímco obsah plazmy VIII:EF zůstává normální.
Faktor VIII:FROM - neenzymatický urychlovač faktoru IXa, se kterou tvoří komplex na fosfolipidové matrici. VIII je aktivován:S principem zpětné vazby malých dávek trombinu (IIa) a, možná, faktor Xa; zároveň se disociuje s PV. Po aktivaci trombin štěpí a inaktivuje faktor VIII:S tím, jak přímo, a nepřímo aktivací proteinu C.
Interakce mezi vnějším a vnitřním mechanismem srážení krve
V těle nejsou odděleny vnější a vnitřní mechanismy aktivace systému srážení krve, a důvěrně spolu interagují. Tak, faktor XII + kalikrein aktivuje faktor VII. Významnou roli hraje také vzájemná aktivace faktorů VIIa a IXa, stejně jako VIIa a Xa.
Faktor VIIa je také částečně aktivován plazmatickými lipoproteiny a triglyceridy, a retrográdně s trombinem. Detekce aktivace a zvýšení hladiny faktoru VIIa proto slouží jako globální marker intravaskulární aktivace krevního koagulačního systému a vysokého trombogenního rizika, zejména s ischemickou chorobou srdeční a hyperlipidémií.
Stejně jako u externích, a s vnitřními koagulačními mechanismy interakce a aktivace faktorů se provádějí na fosfolipidových mikromembránách, sloužící jako matrice, na kterých jsou upevněny (pomocí vápenatých iontů), měnit jejich kvartérní a terciární strukturu, proteinové faktory na sebe intenzivně reagují. Úlohu takových matric plní membrány destičkových membrán a granulí (faktor 3 Destiček) a podobné složky z membrán jiných buněk (erytrocyty atd.). Do značné míry rozhoduje přítomnost těchto fosfolipidových membránových matric, že, za jinak stejných okolností, doba koagulace plazmy, obsahující malé množství krevních destiček, delší, než je doba srážení plazmy při normálním počtu krevních destiček, a pak, co gemoliz (uvolnění membrán červených krvinek) výrazně urychluje koagulaci a zkresluje hodnoty koagulačních testů (činí hemolyzovanou krev nevhodnou pro studium systému srážení krve).
Vzhledem k různým podmínkám aktivace fosfolipidů podléhají hodnoty nestandardizovaných koagulačních testů velmi velkým náhodným výkyvům. Tento rozptyl se vlivem nestejné intenzity ještě zvětšuje (vlastnosti skla zkumavky) a trvání kontaktní aktivace faktoru XII. Standardizace koagulačních testů kontaktem (získávání a zpracování krve za podmínek silikonizace laboratorního skla nebo ve fluoroplastových zkumavkách s následnou maximální aktivací kontaktní fáze s kaolinem) a aktivací fosfolipidů (přidání standardního množství cefalinu) jsou mnohem přesnější a reprodukovatelnější.
Na hodnocení koagulační aktivity krevních destiček Měl by být porovnán čas srážení kaolinu plazmy s vysokým a nízkým obsahem krevních destiček (vyloučením cefalinu z reakce).
Tak, kompletní posouzení koagulačního procesu při jeho spuštění podle vnitřního mechanismu se provádí studiem celkové doby srážení krve pomocí standardizovaných testů - kaolin a kaolin-kefalin (aktivovaný parciální tromboplastinový čas), stejně jako dvoustupňový autokoagulační test.
Podobným způsobem se aktivuje a inaktivuje další neenzymatický urychlovač koagulace - faktor V, interakce s faktorem X. Tento komplex se v literatuře nazývá protrombináza. (podle zastaralé terminologie - krevní tromboplastin), ve kterém aktivní enzymovou částí je faktor Xa, přeměnu protrombinu na trombin. Na fosfolipidové matrici (např, na membránách krevních destiček) činnost tohoto komplexu v 1000 krát vyšší, než v nepřítomnosti fosfolipidů. Komplex Va-Xa v 3000 krát více, než faktor Xa. Tak, faktor Va a fosfolipidová matrice společně zvyšují protrombinázovou aktivitu ve srovnání s izolovaným faktorem Xa v 300000 doba.
Na povrchu každé destičky je cca 3000 fosfolipidových receptorů na komplex Va-Xa, z toho o 1000 receptory s vysokou afinitou. Fosfolipidové mikromembrány kefalinových a erytrocytových membrán mohou sloužit jako matrice pro všechny komplexy koagulačních faktorů (erytrocyt, erytrofosfatid), který je široce používán v laboratorní praxi.
Při aktivaci faktorem Xa se protrombin přemění na aktivní α-trombin. V tomto případě je z něj postupně oddělován fragment 1 a zůstává pretrombin 1, a pak fragment 2 a zůstává pretrombin 2. Tímto štěpením se jednořetězcová molekula protrombinu přemění na dvouřetězcovou. (rozštěpy A a B) molekula α-trombinu. Poté podstoupí autolýzu a ztratí aktivitu, a je také inaktivován fyziologickými antitrombiny.
Pod vlivem jiných endos- a exogenní (hadí jedy atd.) proteolytické enzymy mohou tvořit formu trombinu, lišící se od α-trombinu slabší koagulační aktivitou, menší citlivost na komplex heparin-antitrombin III a další vlastnosti.
Ionizovaný vápník je nezbytný pro srážení krve, protože je zapojen do následujících procesů:
- molekulární konformace koagulačních faktorů do aktivní formy;
- fixace interagujících faktorů na fosfolipidové matrice;
- urychlení aktivace jednotlivých faktorů jejich spojováním (např, přeměna protrombinu na trombin urychluje Ca++ v 1000 krát jeho připojením k y-karboxyglutamylovým zbytkům v NH2-koncová část molekuly).
Při analýze výsledků základních koagulačních testů je důležité vzít v úvahu následující::
- v používaných testovacích systémech je faktor VII zapojen pouze do vnějšího mechanismu procesu, kvůli kterému při jeho nedostatku jen asi- trombinový čas;
- faktor XII, XI, IX, VIII a prekalikrein se účastní mechanismu vnitřní aktivace, proto, když jsou deficitní, APTT a ACT jsou narušeny, zatímco protrombinový čas zůstává normální;
- s nedostatkem faktorů X, PROTI, II a I, na kterém jsou uzavřeny oba koagulační mechanismy, patologie je detekována ve všech výše uvedených testech.
Vnější a vnitřní aktivační mechanismy však nejsou od sebe izolovány, interagovat navzájem.
Tak, byla odhalena vzájemná aktivace faktoru VII a faktorů IX a X, stejně jako aktivace faktoru VII komplexem XIIa–kalikrein–VMC. Zařazení těchto „mostů“ mezi vnitřní a vnější mechanismy slouží jako jedno z diagnostických kritérií pro pretrombotický stav nebo latentní intravaskulární koagulaci. To se projevuje zvýšením aktivity faktoru VII v krevní plazmě při jeho testování na plazmě, bez tohoto faktoru, a také použitím testu aktivace protrombinovým časem za studena s bovinním tromboplastinem.
V játrech je syntetizováno mnoho koagulačních a fibrinolytických faktorů. Z nich faktory II, VII, X a IX, stejně jako antikoagulancia - proteiny C a S K- vitamín závislý: poslední fázi jejich syntézy (karboxylace) narušený nedostatkem fylochinonu (Vitamín K) a pod vlivem jeho antagonistů – kumarinů, fenylen atd. V tomto případě je narušena tvorba K-vitamín-dependentní karboxylázy v hepatocytech, který zbavuje koagulační faktory schopnosti aktivace. Byla popsána dědičná hemoragická diatéza, u kterých je v důsledku narušení syntézy této karboxylázy snížena hladina všech koagulačních faktorů závislých na K-vitaminu.
Na rozdíl od tohoto, Faktor V a řada složek fibrinolytického a kalikrein-kininového systému jsou syntetizovány v játrech nezávisle na fylochinonech.
