Studium srážení krve
Způsoby zkoumání koagulační systém zahrnuje následující skupiny:
- Indikativ (obecný), dává představu o stavu celého koagulační kaskády jako celku a jeho jednotlivých etapách (registrace lze provést vizuálně nebo pomocí samostatných zařízení - koagulografu, tromboelastograf atd.);
- diferencující deficit jednotlivých faktorů - korektivní koagulační testy, testy míšení studované krevní plazmy s krevní plazmou pacientů se známým deficitem určitých faktorů;
- kvantitativní určení jednotlivých složek systému jejich funkční činností (koagulační testy, studie na chromogenních a jiných substrátech) a (nebo) imunologickými markery;
- identifikace intravaskulární aktivace procesu krevní koagulace a fibrinolýzy funkčními charakteristikami nebo molekulárními markery takové aktivace - identifikace aktivovaných koagulačních faktorů v oběhu, produkty degranulace krevních destiček, rozpad složek krevního koagulačního systému nebo jejich metabolitů, vznik nových antigenních markerů aktivovaných faktorů a jejich komplexů, zrychlená metabolizace značených složek krevního koagulačního systému (snížení jejich poločasu v oběhu).
Tak, při hodnocení stavu systému srážení krve se používají jako koagulační techniky (laboratorní a přístrojové), tvoří základ diagnostického procesu, a imunologické, radionuklidy a další typy výzkumu. Navíc v mnoha případech mohou být součásti systému určeny jak funkční činností, a imunologicky - podle obsahu odpovídajícího antigenu v krvi. Paralelní použití takových technik umožňuje odlišit formy patologie, spojené s nedostatkem syntézy odpovídajícího koagulačního faktoru (v tomto případě je obě jeho funkční aktivita stejně snížena, a množství antigenu), a tvary, ve kterém je molekula faktoru syntetizována, ale je abnormální a funkčně vadná.
Pro označení prvních forem se k číslu odpovídajícího faktoru přidá znak „—“. (např, VIII-, IX- a t. d.), a ve druhém - znaménko „+“. (např, VIII+, IX+).
Přibližný (obecný) koagulační testy
Stanovení doby srážení krve
Stanovení doby srážení krve (lepší než Lee-White technika) - dlouho používaný, rychlá realizace (přímo u lůžka pacienta) orientační test, umožňující odhalit významné krvácivé poruchy, spojené s nedostatkem hemokoagulačních faktorů (kromě faktoru VII) nebo s působením antikoagulancií a fibrinolytik. Používá se jako orientační test a ke sledování heparinové terapie, eliminaci účinku heparinu s protaminsulfátem. Test je relativně málo citlivý, jeho ukazatele jsou porušeny pouze s výrazným poklesem obsahu koagulačních faktorů v plazmě (pod 4-5 %), proto není vhodný pro detekci mírných forem hemofilie A a B, stejně jako poruchy srážlivosti krve u angiohemofilie, nedostatek faktoru XI, prekalikrein a vysokomolekulární kininogen. Z těchto důvodů nelze test použít k předoperačnímu vyšetření pacientů.: s normálními výsledky testů (5-10 min) může dojít k hojnému pooperačnímu krvácení.
Doba rekalcifikace plazmy
Doba rekalcifikace plazmy - nestandardizovaný test nízké citlivosti, méně spolehlivé pro detekci hypokoagulace, než doba srážení plné krve. Nelze doporučit pro diagnostiku poruch hemostázy.
Aktivovaný plazmatický parciální tromboplastinový čas
Aktivovaný plazmatický parciální tromboplastinový čas (APTV, kaolin-kefalinový test) - vysoce citlivá metoda, detekce poruch srážlivosti krve, když se proces spustí prostřednictvím vnitřního mechanismu. Selektivně citlivý na nedostatek plazmatických koagulačních faktorů (od nedostatku krevních destiček a faktoru 3 trombocyty jsou kompenzovány externě podávaným cefalinem nebo erytrofosfatidem).
Používá se ke sledování heparinové terapie, předoperační vyšetření pacientů atd.. d. Standardní indikátory závisí na použitých vzorcích kefalinu, ve většině případů je to 37-50 s (optimální - 37-45 s).
Čas kaolinové plazmy
Plazmový kaolinový časový test, podobný předchozímu, ale bez přidání cefalinu do plazmy (erytrofosfatid), v důsledku toho je citlivý nejen na nedostatek plazmatických koagulačních faktorů, ale také na nedostatek krevních destiček a faktoru 3 Destiček. Přibližné posouzení aktivity tohoto faktoru lze provést porovnáním kaolinového času plazmy testovaného subjektu s vysokým a nízkým obsahem krevních destiček (norma - 57-70 s).
Použití fosfolipidových složek se nedoporučuje, dává v APTT dobu srážení rovnající se 55 s nebo více, protože to prudce snižuje přesnost a reprodukovatelnost testů, včetně kvantitativního stanovení faktorů VIII a IX.
Doba silikonové plazmy
Doba silikonové plazmy je doba rekalcifikace plazmy, získané silikonizací jehel, zkumavky, pipeta, T. to je. s minimální aktivací kontaktu. Test je citlivý na hyperkoagulaci – intravaskulární aktivaci počáteční kontaktní fáze (faktory XII a XI), tato porucha se však jasněji identifikuje stanovením doby srážení silikonu celé krve (na základě Lee-White metody nebo tromboelastografického záznamu procesu v silikonizované kyvetě).
Standardní indikátory závisí na použitém silikonu a jsou stanoveny testováním krve zdravých lidí pro každý vzorek zvlášť.. Při výběru silikonu je nejlepší ten, která v největší míře prodlužuje dobu srážení krve (plazma).
Protrombin (tromboplastin) plazmový čas
Protrombin (tromboplastin) plazmový čas (Kwik čas, index protrombin) charakterizuje rychlost koagulace rekalcifikované krevní plazmy, když je proces spuštěn vnějším mechanismem, T. to je. s přídavkem tromboplastinu lidského mozku (nebo králíka).
Tromboplastinová aktivita standardizované na smíšené vzorky normální (řízení) plazma. Nejčastěji se používají tromboplastiny s aktivitou 12-18 s. (klasickou metodou Quick - 12-13 s). Čím slabší je tromboplastin, tím větší chyba metody.
Při normálním plazmatickém protrombinovém čase umožňuje test identifikovat izolovaný nebo kumulativní nedostatek faktorů protrombinového komplexu - VII, X, V a II, z toho tři faktory (VII, X a II) K-vitamíny jsou závislé a jejich aktivita se vlivem nepřímých antikoagulancií snižuje. V tomto ohledu je hlavním při sledování dávkování kumarinů protrombinový test (neodikumarin, nebo pelentan, Sinkumar a kol.) a další drogy z této skupiny (fenilin).
Protrombinový čas zůstává normální při deficitu faktorů vnitřního mechanismu aktivace protrombinázy - faktorů XII, XI, IX, VIII (T. to je. pro všechny typy hemofilie a Hagemanovy vady), stejně jako s deficitem prekalikreinu a vysokomolekulárního kininogenu (VM kininogen)
V literatuře jsou přijímány různé věci označení výsledků protrombinového testu. Nejvhodnější je indikovat protrombinový čas testu a kontrolní krevní plazmu v sekundách (který také poskytuje informace o aktivitě použitého tromboplastinu). Někdy se používá poměr těchto dvou veličin, T. to je. index (PT zkušební plazmy, z ,)/(PT kontrolní plazmy, z), (norma je 0,9-1,1).
Další forma hodnocení tohoto ukazatele, který se nejvíce používá v laboratořích, je výpočet protrombinového indexu v procentech sestavením inverzního aritmetického podílu (norma — 90-110 %), tento výpočet je však nesprávný, protože existuje nearitmetický vztah mezi koncentrací faktorů srážení a dobou srážení, a logaritmickou závislost. Kromě, protrombinový test je citlivý pouze na pokles níže uvedených koagulačních faktorů 50 % jejich normální velikost. Z tohoto důvodu je vhodné použít stanovení protrombinového indexu v procentech podle křivky ředění (1:2, 1:4, 1:8 a t. d.) smíšený vzorek normální plazmy. Tato křivka je sestrojena jednou pro tromboplastiny různých počátečních aktivit (z 12 na 18 z) a používá se ke stanovení protrombinového indexu u studovaných pacientů. Výhodou této techniky je také to, že výsledky všech studií, včetně těch, které se provádějí dynamicky v různých dnech, nesouvisejí s náhodně odlišnými vzorky normální krevní plazmy, a na zprůměrované stejné standardní parametry, v důsledku toho se výrazně sníží chyba metody. Indexy, získané z křivky podílu a ředění normální plazmy, navzájem zcela nekonzistentní. To je třeba vzít v úvahu i při sledování účinku nepřímých antikoagulancií., protože snížení obvyklého indexu na 50 % přibližně odpovídá poklesu indexu podél křivky ředění na 25-30 %• V tomto ohledu by analýzy měly vždy ukazovat, Jak se vypočítal protrombinový index?, jaké jsou jeho standardní ukazatele pro tromboplastin této aktivity.
Plazmatický trombinový čas
Plazmatický trombinový čas, T. to je. doba srážení citrátové plazmy, když je k ní přidán trombin standardní aktivity, je hlavním testem pro posouzení konečného stadia koagulace krve. Zohlednění tohoto ukazatele je důležité pro správnou interpretaci všech ostatních koagulačních testů, protože narušení konečného stádia srážení krve by u všech výše uvedených metod nevyhnutelně mělo vést ke zvýšení doby srážení.
Ve většině případů se při provádění trombinového testu používá tato koncentrace roztoku trombinu, který po smíchání se stejným objemem krevní plazmy produkuje koagulaci za 12– 18 z, ale při rozpoznání dysfibrinogenémie se používají i slabší koncentrace (což vede ke koagulaci za 30-35 s).
Trombinový čas - důležitý diagnostický ukazatel, jeho porušení je pozorováno jako u vrozených, a s často se vyskytujícími získanými (sekundární) hypoprotrombinémie, s většinou dysfibrinogenemií, a také pod vlivem heparinu, produkty fibrinolýzy (PDF) a řada dalších antitrombinů a inhibitorů samouspořádání fibrinových monomerů. Z tohoto důvodu je trombinový čas primárně a ve větší míře narušen u akutních a subakutních syndromů DIC, který hraje důležitou roli pro rychlou diagnostiku této patologie.
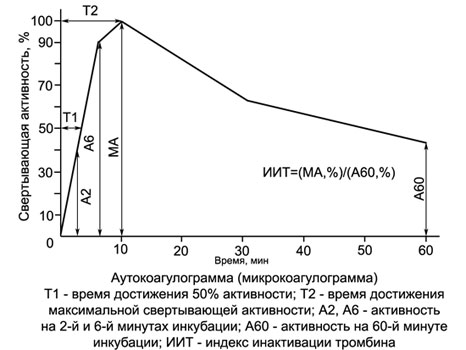
Autokoagulační test
Autokoagulační test (AKT) - vysoce citlivý dvoustupňový, charakterizuje proces srážení krve, když je spuštěn vnitřním mechanismem. Stejně jako APTV, test není citlivý na nedostatek faktoru VII, ale zároveň jeho indikace nezávisí na obsahu fibrinogenu (faktor I) ve studované krevní plazmě, jak se liší od všech ostatních indikativních koagulačních testů.
Další výhodou ACT je to, že se testuje zředěná krev, díky čemuž je citlivost testu na deficit koagulačních faktorů a, Kromě, provádění ACT nevyžaduje použití kaolinu a cefalinu, protože standardizace kontaktu a aktivace fosfolipidů v něm je dosažena hemolyzátem vlastních červených krvinek testovaného subjektu.
Podstatou ACT je, co 2 ml hypotonického roztoku (0,222 %) přidá se chlorid vápenatý 0,1 ml krve subjektu.
V této směsi hemolyzát-vápník se tvoří protrombináza a trombin, jehož aktivita je určena sekvenčním přidáváním 0,2 ml této směsi do 0,2 ml plazmy subjektu (každý 2 min během prvního 10 m, a pak každý 10 minut 1 žádná).
Plazma subjektu je zdrojem fibrinogenu, na kterém se testuje aktivita trombinu vzniklého ve směsi. Jak ukázaly četné studie, lze jej nahradit krevní plazmou zdravých lidí nebo roztokem fibrinogenu. V tomto případě se spotřeba krve pacienta sníží na 0,1-0,2 ml (lze sejmout z prstu!), co transformuje autokoagulační test na mikrokoagulační test (ICT) a je velmi vhodný pro použití v pediatrii, včetně při studiu hemostázy u novorozenců.
Koagulační aktivita u ACT a MCT zpočátku se zvyšuje a u zdravých lidí obvykle dosahuje maxima do 10. minuty, inkubace směsi krve a vápníku (KCS), kdy koagulace substrátové plazmy nastane za 10±1 s. Poté začne koagulační aktivita CCS klesat, což ukazuje na inaktivaci v něm vytvořeného trombinu. U hemofiliků, expozice heparinu a dalším poruchám koagulace je koagulační aktivita CCS prudce snížena, a maximum se přesune z 10. minuty na pozdější datum. Při hyperkoagulaci je pozorováno dřívější a výraznější zvýšení aktivity trombinu v CCS.
Při provádění testu v jedné zkumavce (stanovení pouze v 10. minutě inkubace CCS) lze jej použít ke sledování heparinové terapie. Výhodou této techniky oproti testu aktivovaného parciálního tromboplastinového času je to, že neutralizuje nestejný vliv různých cefalinů na dobu srážení heparinu.
Na základě ACT (ICT) byla vyvinuta jednoduchá a přesná metoda pro diferenciální diagnostiku hemofilie.
Pomocí převodních tabulek uvedených v referenčních knihách, hodnoty ACT (ICT) lze vyjádřit v procentech a znázornit jako graf - autokoagulogram.
Instrumentální metody výzkumu jsou také široce používány k posouzení řady obecných parametrů srážení krve., především pomocí různých koagulografů a tromboelastografů.
Tromboelastografie dává představu nejen o časových parametrech srážení krve či plazmy, ale také o struktuře a mechanických vlastnostech výsledných sraženin. V posledních letech byla do hardwarových registračních metod zavedena standardizace kontaktní a fosfolipidové aktivace koagulačního procesu.. Vznikají také koagulogramy pro hromadné provádění obecných koagulačních testů - APTT, protrombin, trombin a další s automatickým záznamem výsledků.
Metody diferenciace deficitů různých koagulačních faktorů a jejich kvantifikace
Údaje v tabulce níže ukazují, že indikativní studie krevní koagulace pomocí tří hlavních testů umožňuje skupinovou diferenciaci deficitu různých plazmatických hemokoagulačních faktorů. Tak, zpomalení koagulace pouze v protrombinovém testu (I typ porušení) při normálních hodnotách pro všechny ostatní je charakteristický dědičný nedostatek faktoru VII nebo snížení hladiny tohoto faktoru v raných fázích rozvoje obstrukční žloutenky nebo v prvních 1-2 dnech léčby nepřímými antikoagulancii, když potlačení syntézy faktoru VII postupuje v jeho vývoji pokles hladiny všech ostatních koagulačních faktorů závislých na vitaminu K.
Typy porušení hlavních koagulačních testů s nedostatkem určitých plazmatických koagulačních faktorů | ||||
Typ porušení | Deficitní faktory ve studované krevní plazmě | Koagulační testy | ||
APTV, AKT | PV | televize | ||
| Já | VII | – | + | – |
| II | XII | + | – | – |
| XI | + | – | – | |
| IX | + | – | – | |
| VIII | + | – | – | |
| Faktor ve Willebrandovi | + | – | – | |
| Plazmatický prekalikrein | + | – | – | |
| VM kininogen | + | – | – | |
| III | II | + | + | – |
| PROTI | + | + | – | |
| X | + | + | – | |
| VII | – | + | – | |
| IX | + | – | – | |
| Já | + | + | + | |
| XIII | – | – | – | |
| IV | Přímá antikoagulancia (Heparin, heparinoidy atd.) | + | + | + |
| Nepřímá antikoagulancia (kumarinы) | + | + | – | |
| Poznámka. (+) - zpomalení koagulace; (-) - žádná porucha srážlivosti. | ||||
Pouze narušení vnitřního koagulačního mechanismu, T. to je. aktivovaný parciální tromboplastinový čas a ACT (II typ), pozorováno při nedostatku faktoru XII, XI, IX, VIII, von Willebrand (ne ve všech formách), prekallikrein a kininogen VM. Z toho u dědičných poruch koagulace nedostatek faktoru XII, prekalikrein a VM kininogen jsou pozorovány extrémně vzácně a nejsou doprovázeny žádným krvácením, zatímco nedostatek faktoru VIII (hemofilie A), IX (hemofilie v) a von Willebrandův faktor je velmi častý (je větší než 96 % všechny dědičné koagulopatie) a je doprovázeno těžkým krvácením. Mezi nimi se nejprve provádí další diferenciální diagnostika..
Nedostatek faktoru XI je poměrně vzácný (asi 0,5-1,0 % všechny hemofilie), dochází při velmi mírném krvácení (hlavně po úrazech a operacích) a zaujímá mezilehlé místo mezi první podskupinou asymptomatických poruch a hemofilií a von Willebrandovou chorobou.
Další typ poruchy je charakterizován prodloužením jak parciálního tromboplastinového času, tak ACT, a protrombinový čas. Je charakteristický pro nedostatek faktoru V, X nebo II nebo pro komplexní deficit všech K-vitamin-dependentních faktorů (VII, X, IX, II), co je pozorováno u obstrukční žloutenky a jiných typů nedostatku vitaminu K, a také při užívání nepřímých antikoagulancií.
A nakonec, jak je vidět z téže tabulky, Možné porušení všech tří testů (IV typ), co se pozoruje u dědičné a získané hypo- a dysfibrinogenemie (ne vše), při užívání přímých antikoagulancií (geparina, heparinoidy, Girudin a další.), léčba aktivátory fibrinolýzy a defibrinačními léky (streptokináza, urokináza atd.), výskyt patologických antitrombinů a látek v krvi, brání připojení (shromáždění) fibrinové monomery – paraproteiny, kryoglobuliny, imunitní komplexy, i u komplexních krvácivých poruch, způsobené syndromem DIC. V tomto případě je trombinový čas často narušen ve větší míře a poněkud dříve, než jiné testy.
S přihlédnutím k délce trvání onemocnění a možnosti jeho dědičné geneze nebo sekundární souvislosti s jinými typy patologie a léčivými či jinými vlivy, přítomnost či nepřítomnost krvácení a jeho typ, je možné správně určit genezi těchto hlubokých poruch srážlivosti krve.
Všechno diferenciační testy jsou založeny na principu korekce, T. to je. na definici, do jaké míry se zjištěná krvácivá porucha upraví popř, naopak, není eliminován vzorky krevní plazmy nebo uměle získanými krevními produkty se známým deficitem určitého koagulačního faktoru.
Za tímto účelem si specializované laboratoře vytvářejí sbírky krevní plazmy s deficitem faktoru., přijímat je od pacientů se známou hloubkou (méně 1 %) nedostatek každého z faktorů a skladujte je v malých obalech (podle 0,5 ml) při teplotě - 30 ° C. V případě potřeby se tyto vzorky rozmrazí a použijí při diagnostických testech..
Plazma, náhodně rozmražené nebo ponechané bez použití, nelze znovu zmrazit. V korekčních testech by se neměla používat plazma s imunitními inhibitory určitého faktoru.. Diagnostické soupravy od řady společností obsahují lyofilizované vzorky krevní plazmy s nedostatkem detekovatelných koagulačních faktorů (substrátová plazma). Řada krvácivých poruch je však v klinické praxi extrémně vzácná., v tomto ohledu se používají uměle připravené složky normální krve s deficitem některých koagulačních faktorů, stejně jako heterogenní plazmy (kuřata, kachňata atd.).
V tabulce jsou uvedeny informace o obsahu faktorů srážení krve v krevních složkách, používá se pro korekční koagulační testy v závislosti na jejich skladovatelnosti. Pomocí této tabulky, snadné dešifrování hodnot kteréhokoli ze tří hlavních koagulačních testů. V nápravných metodách tohoto druhu se používají testy, standardizované pro kontaktní a fosfolipidovou aktivaci, T. to je. kaolin-kefalin nebo pomocí hemolyzátu (v AKT).
Obsah koagulačních faktorů v krevní plazmě s různou dobou skladování, používá se pro opravné testy | ||
Krevní plazma | Faktor srážení | |
vnitřní mechanismus | vnější mechanismus | |
VIII IX XI XII prekalikrein | VII X V II | |
| Rodák (s trvanlivostí až 18 žádná) | ++++ | ++++ |
| Adsorbovaný * | +-++ | –+- |
| S trvanlivostí více než 24 žádná | -+++ | ++– |
| S dobou použitelnosti 2-4 dny (při teplotě +4°C) | Nepoužívá | ++-+ |
| Filtrovaný ** | Nepoužívá | –++ |
| Nativní plazma kuřat nebo kachňat (do 3-4 dnů věku) | +++- | Nepoužívá |
| Poznámka. (+) — přítomnost faktoru; (-) - nepřítomnost. | ||
| * Adsorpce se provádí buď síranem barnatým z oxidované plazmy (sklenka4-plazma). nebo gel hydroxidu hlinitého z citrátové plazmy (Pro(ACH)3-plazma). | ||
| ** Filtrace se provádí přes dva azbestové filtry (Seitz filtry) — s 20 % (horní filtr) a 30 % (spodní filtr) obsah azbestu se zdvojnásobil nebo ztrojnásobil 30 a 20 % filtry. | ||
Testy na míšení pacientovy krevní plazmy s plazmou, mající známý nedostatek jednoho nebo druhého faktoru
Stanovte aktivovaný parciální tromboplastinový čas v testované krevní plazmě, normální plazma (ŘÍZENÍ) a v plazmě se známým nedostatkem faktoru VIII (od pacienta s hemofilií A), IX (od pacienta s hemofilií B), XI a XII. Poté se připraví směs ze vzorků citrátové plazmy testovaného subjektu. (7/10 objem) a následně s každou z deficitních plazmat (3/10 objem), počínaje nedostatkem faktoru VIII a IX (nejběžnější formy patologie!).
Do směsi se přidá kaolin a kefalin, a 2 doly podléhají rekalcifikaci (na 37 ° C). V míchal, kde se aktivovaný parciální tromboplastinový čas nenormalizuje, mají stejnou koagulační vadu.
Tak, pokud aktivovaný parciální tromboplastinový čas vyšetřovaného pacienta není normalizován přidáním krevní plazmy od pacienta se známým nedostatkem faktoru VIII, ale je korigován krevní plazmou od pacienta s nedostatkem faktoru IX, má hemofilie A.
Podobně,, ale na základě protrombinového testu je diferencován deficit faktorů protrombinového komplexu (X, PROTI, VVIVIVIVIVIVIVE .).
Test tvorby tromboplastinu
K odlišení poruch vnitřního mechanismu srážení krve se používá klas test tvorby tromboplastinu s výměnou destičkových komponent, jehož příprava vyžaduje značnou investici času a krve, cephalin Nevýhody testu tvorby tromboplastinu jsou jeho objemnost, potřeba připravit velké množství činidel, značný čas vynaložený na jeho realizaci.
Korekční test, na základě autokoagulačního testu.
Další opravný test plně splňuje cíle expresní diagnostiky., na základě korekce stejnými složkami normální krve na základě autokoagulačního testu.
Tento test je vysoce spolehlivý, rychlé a snadné provedení a vyžaduje jen málo (ne více 0,5 ml) množství krve subjektu, což umožňuje jeho použití v pediatrické praxi.
V něm, jako v testu tvorby tromboplastinu, Ke korekci se používá adsorbovaná plazma a staré krevní sérum, který se před studií znovu odstředí. Nalijte do tří zkumavek 2 ml 0,222 % roztok chloridu vápenatého a přidejte do dvou z nich 0,1 ml adsorbované normální krevní plazmy (1-Jsem zkumavka) a 0,1 ml starého normálního krevního séra (2-Jsem zkumavka). Do tří dalších zkumavek přidejte 0,2 ml normální citrátové plazmy. Poté přidejte každou zkumavku obsahující roztok chloridu vápenatého. 0,1 ml citrátové krve subjektu.
Přesně v 4 min inkubace této směsi, její srážecí aktivita je testována na normální plazmě.
Prudký pokles koagulační aktivity pouze v první zkumavce (s normálním BaSO4-plazma) indikuje, že pacient má nedostatek faktoru IX (hemofilie v), pouze ve druhé zkumavce (se starým sérem) — o nedostatku faktoru VIII (hemofilie A); dojde-li ke korekci v obou zkumavkách (stejně silné), pak, samozřejmě, je nedostatek faktoru XI nebo XII (cm. Stůl. 14).
Koagulační testy, odlišení poruch srážlivosti krve vnitřním mechanismem (s normálním protrombinovým a trombinovým časem) | |||
Deficitní faktory ve studované krevní plazmě | Složky normální krve, přidán do testované plazmy | ||
Adsorbovaná plazma (bez faktoru IX) | Staré sérum (bez faktoru VIII) | Směs adsorbované plazmy a starého séra | |
| Faktor VIII | + | – | + |
| Faktor IX | – | + | + |
| Faktory XI nebo XII | + | + | + |
| Poznámka. (+) - normalizace koagulace; (-) - nedostatečná normalizace koagulace. | |||
Tento test je vysoce citlivý, protože studie je prováděna na zředěných 20 krát krev při kompenzaci faktoru 3 krevní destičkový hemolyzát. Jediným použitým činidlem je hypotonický roztok chloridu vápenatého, co dělá vzorek veřejným.
Technika korekčních testů je stejně jednoduchá., prováděno na základě protrombinového testu k odlišení deficitu faktoru II, V a VII+, X (v tabulce).
Koagulační testy, deficit diferenciačního faktoru II, V a VII+, +X, prováděno na základě protrombinového testu (s normálním trombinovým časem) | ||||
Deficitní faktory ve studované krevní plazmě | Složky normální krve, přidán do testované plazmy | |||
Adsorbovaná plazma (bez faktorů II, VII, X) | Stará plazma (bez faktoru V) | Filtrovaná plazma (bez faktorů 4. X-Proxing je jednoduchost.) | Staré sérum (bez faktorů II zahraniční od V) | |
| Faktory VII nebo X | – | + | – | + |
| Faktor V | + | – | + | – |
| Faktor II | – | + | + | – |
| Poznámka. (+) - normalizace koagulace; (-) - nedostatečná normalizace koagulace. | ||||
K rozlišení mezi nedostatkem faktoru VII a faktoru X, provádí se doplňkový koagulační test s přídavkem roztoku hadího jedu zmije do vyšetřované krevní plazmy - lék. lebetox (zvolí se taková koncentrace jedu, který v přítomnosti kefalinu a chloridu vápenatého způsobuje koagulaci za 20-25 s; všechny přísady se odebírají v množství 0,1 ml a promíchejte) (tabulka níže).
Ke stejnému účelu se používá přípravek z jedu zmije Russell., žijící v Indii (příprava stiven).
Koagulační testy, odlišení deficitu faktorů VII a X pomocí jedu zmije (lebetox) | |||
Deficitní faktory ve studované krevní plazmě | Zkoušky | ||
s jedem zmije + kefalin + chlorid vápenatý | s jedem zmije + kefalin + chlorid vápenatý + filtrovaná krevní plazma (zdroj faktorů Va VIII) | protrombin | |
| Faktor X | – | – | – |
| Faktor VII | – | + | + |
| Poznámka. (+) - normalizace koagulace; (-) - nedostatečná normalizace koagulace. | |||
Diferenciální diagnostika je v případě potřeby doplněna kvantitativním stanovením deficitních faktorů nebo jejich specifických imunitních inhibitorů, Proč se používají speciální vysoce citlivé standardizované techniky?. Tyto techniky využívají konstrukci dilučních křivek směsných vzorků normální krevní plazmy s korekcí deficitu všech faktorů, kromě zkoumaného. Tyto křivky se používají ke stanovení aktivity testovaného faktoru v plazmě pacientů..
Zvláště je důležité kvantifikovat koncentraci faktorů VIII a IX, stejně jako přítomnost jejich inhibitorů u pacientů s hemofilií A a B (zejména před a během operace a během intenzivní substituční terapie), stejně jako s opožděným profuzním poporodním krvácením, kdy je nutné odlišit syndrom DIC od vzácnější patologie - objevení se imunitního inhibitoru faktoru VIII (ještě mnohem méně často - faktor V).
Se závažným nedostatkem faktoru XIII (velmi vzácná dědičná patologie) všechny koagulační testy jsou v normě, ale sraženiny se rozpustí v 5M nebo 7M močovině.
Pomáhá také odlišit deficit různých koagulačních faktorů zohledněním stupně a, zvláště, načasování normalizace testovacích hodnot po intravenózním podání krevních produktů pacientům, T. to je. zaúčtování opravy žít podle metody L. 3. Všechno.
Tato technika je zvláště účinná, když existuje velký rozdíl v očekávané délce života diferencujících faktorů v oběhu. Tak, Poločas faktorů protrombinového komplexu se pohybuje od několika hodin (faktor VII) až několik dní (faktor II). Faktory X mezi nimi zaujímají mezilehlou pozici (2- 2,5 dne) a V (12— 18 hodin).
Proto se po masivní tryskové transfuzi plazmy protrombinový index s deficitem faktoru VII velmi krátce zvýší, s nedostatkem faktoru V - o něco déle (asi 4-6krát), a s nedostatkem faktorů X a, zvláště, II na delší dobu (během 1-2 dnů). Indikativní je v tomto ohledu účinek léku PPSB na protrombinový index (koncentrát faktoru VII, IX, X a II). Krátkodobě také normalizuje protrombinový čas v případě nedostatku faktoru VII a déle (mnohokrát!) s deficitem faktorů X a II. Protože tento lék neobsahuje faktor V, tento nedostatek jím nelze napravit.
Podobný rozdíl je odhalen při transfuzní a substituční terapii faktorů vnitřního koagulačního mechanismu (XII, XI, SIV je), co zaznamená aktivovaný parciální tromboplastinový test.
Zvláštního zájmu je dynamika korekce hladiny faktoru VIII a hodnoty aPTT během transfuzní terapie pro hemofilii A a von Willebrandovu chorobu. U prvního z těchto onemocnění dochází k okamžitému maximálnímu zlepšení koagulace po transfuzi. (sprej, rychlý!) podání antihemofilní plazmy nebo kryoprecipitátu, a pak docela rychle (na 10-18h) jeho neustálý pokles, zatímco u von Willebrandovy choroby dochází k určitému zvýšení koagulační aktivity několik hodin po transfuzi, a pak je jeho pokles mnohem pomalejší, než s. V tomto ohledu se v léčbě von Willebrandovy choroby méně často používají náhradní transfuze., než u hemofilie A.
Studium funkční aktivity koagulačních faktorů a složek kalikrein-kininového a fibrinolytického systému pomocí chromogenních substrátů
Metody jsou založeny na studiu aktivity proteolytických enzymů a jejich inhibitorů, podílí se na srážení krve, fibrinolýza a tvorba kininů, intenzitou a rychlostí štěpení peptidů specificky citlivých na tyto enzymy, při degradaci se uvolňuje barvivo (p-nitroanilin).
Stupeň zabarvení reakční směsi určeno spektrofotometricky, a podle jeho intenzity se posuzuje aktivita odpovídajících enzymů (srážecí faktory, kallickreina, plasmin a další.), a inhibicí procesu - o aktivitě enzymových inhibitorů.
Tak, např, účinek heparinu a antitrombinu III lze posoudit oslabením štěpení chromogenních substrátů faktorem Xa nebo trombinem, a aktivita α2-antiplasmin - oslabením účinku plasminu na odpovídající chromogenní substrát. Chromogenní substrát nebo mají digitální označení (např, s-2222), nebo se nazývají chromosiny se zkrácenou předponou, označující tento enzym, na které je tento substrát citlivý (např, Chromozym PL je substrát plasminu, Chromozym TH — trombinový substrát, Chromozym PK — substrát prekalikrein/kalikrein atd. d.).
Chromogenní substráty rozšiřují možnosti studia systému hemostázy, ale pro mnoho laboratoří zatím není dostatečně dostupný. Nějaký výzkum, vyrobený s jejich pomocí, nemají žádné výhody oproti konvenčním koagulačním testům a poskytují výsledky, které se s nimi shodují; v ostatních případech jejich použití zjednodušuje a urychluje výzkum, dělá to přesnější; V třetí - tyto techniky mají samostatný význam a nelze vyměnit koagulační testy (např, prekallikrein stanovení).
Imunologické stanovení složek hemostatického systému
Imunologické stanovení složek hemostatického systému, se provádí způsoby, které jsou:
- Immunoprecipitacii;
- Immunoelektroforeza;
- Radioimunotest a druhá se příslušných antisér
Zároveň se do látky v krevní plazmě antigenu na srážecí faktor (nebo jeho fragmenty), není funkční aktivita, který může být prudce snížen při normálních hladinách antigenu v plazmě. Tato situace je typická pro všechny tyto případy, když se v těle syntetizují abnormální látky (funkčně nedostatečný) faktory, zachování jejich antigennosti, ale chybí schopnost účastnit se hemostázy.
To umožňuje rozlišovat mezi úplným zastavením syntézy odpovídajících faktorů a tvorbou jejich anomálních forem.
Řadu složek hemostatického systému lze však stanovit pouze imunologicky.
Tato skupina zahrnuje takové důležité studie, jako definování následujících komponent:
- β-tromboglobulin;
- α2-makroglobulin;
- proteiny C a S;
- antigeny faktoru VIII:C a VIII:Rcof;
- produkty fibrinolýzy (PDF);
- neoantigeny komplexů trombin - antitrombin III a plazmin - antiplazmin;
- řadu dalších testů.
Imunologický výzkum proto významně doplňuje funkční hodnocení různých částí hemostatického systému.
Diagnostické testy, založené na použití léků z hadích jedů jako činidel
Dlouho zavedená, že jedy mnoha hadů obsahují vysoce aktivní proteolytické enzymy, způsobují srážení krve a ovlivňují různé části koagulační kaskády. V důsledku toho se hadí jedy a z nich izolované koagulázy široce používají k rozpoznání hemostatických poruch, kvantifikace srážecích faktorů, detekce a kvantifikace rozpustných komplexů fibrin-monomer (RFMK) a řada dalších studií.
Testy s hadím jedem často velmi zjednodušují a zefektivňují diagnostiku poruch hemostázy..
V tabulce jsou uvedeny údaje o mechanismu působení jedů na systém srážení krve a možnostech diagnostického využití každého z nich.
Hemokoagulační vlastnosti hadích jedů a jejich využití v diagnostické praxi | |||
Jméno hadů * a přípravky z jejich jedů | Mechanismus účinku na koagulační systém | Rozdíly od vlastností přirozených koagulačních faktorů | Možnosti diagnostických aplikací |
| Gyurza Vipera lebetina); lebetox (Russellova zmije; stiven) | Aktivátor faktoru X (v přítomnosti vápníku, faktor V a fosfolipidy **) | Na rozdíl od tkáňového tromboplastinu neobsahuje fosfolipid a nekompenzuje jeho nedostatek. Nevyžaduje faktor VII pro koagulaci | Stanovení faktoru a krevních destiček a jeho uvolňování při agregaci; diferenciace mezi nedostatkem faktoru VII a faktoru X; kvantifikace faktoru X |
| Epha multiscale (Echis multigumatos) a písečná epha (Karinovaní koně); ekarin, ehitoks | Aktivátor faktoru II, tvoří atypický trombin-Em | Na rozdíl od α-trombinu, trombin-Em není blokován heparinem a antitrombinem III, neaktivuje faktor XIII (sraženiny jsou lyžovány v močovině), koaguluje celou zásobu fibrinogenu a všechny rozpustné komplexy fibrin-monomer | Detekce hyperkoagulability, včetně skrytých, během léčby heparinem; kvantitativní stanovení celkového fibrinogenu a RFMC pro diagnostiku trombinémie a DIC- syndrom |
| Bavlník obecný (Aghistrodon hladký hladký), stejně jako mnoho chřestýšů tropické Ameriky a Asie; ancistron-N1, reptiláza, botropklotáza, crotalase, Ankrod atd.. | Koaguluje fibrinogen, štěpí pouze peptidy A a tvoří neúplné monomery fibrinu (des-A-fibrin) | Neodstraňuje peptidy B, neaktivuje faktor XIII a krevní destičky, nezpůsobuje stažení sraženiny, není blokován heparinem, rychle rozkládá sraženiny | Rozpoznání dysfibrinogenémie; posouzení úlohy heparinu v konečném stádiu poruch koagulace (ve srovnání s trombinovým časem) |
| * Všichni tito hadi žijí ve střední Asii (další druhy s podobným mechanismem účinku a značkové přípravky z nich jsou uvedeny v závorce; Zmije Russellova žije v Indii, Daboya zmije - v Austrálii. | |||
| ** Analog kefalinu a destičkového faktoru 3. | |||
Tyto možnosti jsou dále rozšířeny současným použitím několika jedů a nejjednoduššími obecnými koagulačními testy. Tak, např, současné použití koagulačních testů s jedem zmije a efa umožňuje snadno odlišit nedostatek faktoru VII, X-V a II (v tabulce níže), a s další korekcí filtrovanou normální plazmou (zdroj faktorů V a II) -nedostatek faktorů X a V.
Koagulační testy pomocí různých jedů, diferencující deficit faktorů protrombinového komplexu | |||
Deficitní faktory ve studované krevní plazmě | Zkoušky | ||
s jedem zmije + kefalin | s jedem epha | protrombin | |
| VII | + | + | – |
| X+V | – | + | – |
| II | – | – | – |
| Poznámka. (+) - normalizace koagulace; (-)– nedostatečná normalizace koagulace. | |||
Stanovení hlavních fyziologických antikoagulancií
Nejdůležitější je stanovení aktivity hlavního fyziologického antikoagulantu – antitrombinu III, snížení, které může být geneticky podmíněno (primární trombofilie) nebo sekundární v důsledku intenzivní spotřeby (DIC, masivní trombóza) nebo zrychlený metabolismus (léčba heparinem, L-asparagináza, syntetické antikoncepce) a blokáda imunitními komplexy, paraproteiny, fibronektin, proteiny akutní fáze.
V každém případě pokles aktivity antitrombinu III pod 60-65 % podporuje intravaskulární koagulaci, snižuje antikoagulační účinek heparinu. Velmi často však neexistuje přirozená korespondence mezi hladinou antitrombinu III a snížením citlivosti na heparin.
V tomto případě obvykle výrazně převažuje oslabení antikoagulačního účinku heparinu nad stupněm snížení aktivity antitrombinu III.. Prokázané, že u různých forem deficitu antitrombinu III se jeho afinita k heparinu může měnit v různé míře. Kromě, různé frakce heparinu, jejichž poměr v léčivech je velmi proměnlivý, mají také různé afinity k antitrombinu III. Proto je prakticky důležité studovat, jak je skutečná aktivita antitrombinu III, a jeho schopnost přeměnit se vlivem heparinu na rychle působící antikoagulant.
Antikoagulační aktivita antitrombinu III
Antikoagulační aktivita antitrombinu III určeno schopností testované krevní plazmy (rozvedený - Copley-Wintersteinova metoda popř defibrinovaná tepelná denaturace na 56 °C - Loligerovy metody, Abildgarda a kol.) inaktivovat externě podávaný trombin na určitou dobu. Zbytková trombinová aktivita v takové plazmě může být určena její srážecí aktivitou (fibrinogenu, plazma adsorbovaná síranem barnatým) nebo štěpením chromogenního substrátu, citlivé na trombin nebo faktor Xa (protože antitrombin III inaktivuje i tento faktor).
Aktivita kofaktoru heparinu
Heparin-kofaktorová aktivita antitrombinu III obsaženého v krevní plazmě dlouhodobé období bylo stanoveno pomocí plazmatického heparinového tolerančního testu, které lze považovat za orientační, protože poskytuje velmi velký rozptyl normálních ukazatelů a není dostatečně reprodukovatelný.
Výrazně přesnější a reprodukovatelnější testy, ve kterém je studován vliv různých koncentrací heparinu na trombinový čas studované plazmy, obsahující malé množství krevních destiček. Srovnání je provedeno s prodloužením trombinového času kontrolní normální krevní plazmy, ke kterému jsou přidány stejné vzorky heparinu.
Tak, při trombin-heparinovém testu se do testované krevní plazmy přidávají následující množství heparinu:, které v kontrole prodlužují trombinový čas s 15 až 32-35 s (nízká koncentrace) a až 95-110 s (vysoká koncentrace heparinu). Na základě těchto údajů se vypočítají indexy plazmatické aktivity antitrombinu. (AAP) a antikoagulační plazmatická rezerva (ARP).
K hodnocení stupně inaktivace trombinu se široce používají podobné techniky jako při koagulačních testech, a na chromogenních substrátech.
Imunologické stanovení antigenu antitrombinu III
Imunologické stanovení antigenu antitrombinu III umožňuje odlišit různé typy trombofilie:
- s nedostatečnou syntézou antitrombinu III (hladina antigenního markeru je snížena adekvátně poklesu aktivity);
- se zachovanou syntézou abnormálních a funkčně defektních forem (hladina markeru antigenu je mnohem vyšší, než aktivita).
Proteiny C a S, trombomodulin a a2-makroglobulin se stanovuje imunoenzymatickými metodami.
