ห้ามเลือดของหลอดเลือดเกล็ดเลือด – ระบบของการห้ามเลือด
Endothelium, หอการค้าผิวด้านในของหลอดเลือด, มี tromborezistentnostju สูง และมีบทบาทสำคัญในการรักษาของเหลวที่ไหลเวียนเลือด. คุณสมบัตินี้ของ endothelium связано со следующими его особенностями:
- способностью образовывать и выделять в кровь мощный ингибитор агрегации тромбоцитов — простациклин (метаболит арахидоновой кислоты, относящийся к простагландинам);
- продукцией тканевого активатора фибринолиза;
- неспособностью к контактной активации системы свертывания крови;
- созданием антикоагулянтного потенциала на границе кровь/ткань путем фиксации на эндотелии комплекса гепарин — антитромбин III;
- способностью удалять из кровотока активированные факторы свертывания крови.
Вместе с тем стенка сосудов в силу своих анатомо-физиологических особенностей — ригидности, эластичности, пластичности и других — способна противостоять не только давлению крови, но и умеренным внешним травмирующим воздействиям, в силу чего они препятствуют возникновению геморрагий. Это свойство, как и способность противостоять выходу эритроцитов из капилляров путем диапедеза, เสื้อ. มันคือ. через механически неповрежденную стенку сосудов, зависит от полноценности эндотелия и от особенностей строения субэндотелиального слоя — степени развития и качества коллагена и микрофибрилл, соотношения коллагеновых и эластических волокон, структуры базальной мембраны и т. d. Эти свойства в значительной степени зависят от количества и качественных особенностей тромбоцитов, в силу чего при недостаточном их содержании в крови и (หรือ) при тромбоцитопатиях усиливаются как диапедезная кровоточивость, так и ломкость микрососудов: легко возникают петехии и кровоподтеки, становятся положительными пробы на ломкость капилляров — щипка, манжеточная, баночная по А. และ. Нестерову и др.
Микрососуды отвечают на повреждение выраженным локальным спазмом — рефлекторным и связанным с освобождением из стенок сосудов и тромбоцитов адреналина, noradrenaline, серотонина и других биологически активных веществ.
Повреждение стенки сосудов และ, โดยเฉพาะอย่างยิ่ง, оголение субэндотелия способствуют активации свертывания крови и тромбоцитарного гемостаза несколькими путями:
- выделением в кровь тканевого тромбопластина (ปัจจัยที่สาม, apoprotein C) и других активаторов свертывания и агрегации тромбоцитов — адреналина, noradrenaline, АДФ и др.;
- контактной активацией коллагеном и другими компонентами субэндотелия как тромбоцитов (адгезия), так и свертывания крови (активация фактора XII);
- продукцией плазменных кофакторов адгезии и агрегации тромбоцитов — фактора Виллебранда и др.
ดังนั้น, стенка сосудов тесно связана и взаимодействует со всеми другими звеньями системы гемостаза, особенно с тромбоцитами.
Участие тромбоцитов в гемостазе определяется в основном следующими их функциями:
- ангиотрофической — способностью поддерживать нормальную структуру и функцию микрососудов, их устойчивость к повреждающим воздействиям, непроницаемость по отношению к эритроцитам;
- способностью поддерживать спазм поврежденных сосудов путем секреции (реакции освобождения) вазоактивных веществ — адреналина, noradrenaline, серотонина и др.;
- способностью закупоривать поврежденные сосуды путем образования первичной тромбоцитарной пробки (тромба), включающей приклеивание тромбоцитов к субэндотелию (адгезивная функция), склеивание их друг с другом и образование комков из набухших тромбоцитов (агрегационная функция), а также синтез, накопление и секрецию при активации веществ, стимулирующих адгезию и агрегацию;
- тромбопластической — способностью тромбоцитов выделять гемостатические факторы.
Все приведенные данные позволили обосновать учение о единстве сосудисто-тромбоцитарного, или первичного, гемостаза. Основанием для этого учения послужило классическое исследование Дьюка, показавшее, что время кровотечения при проколе кожи мочки уха иглой или скарификатором (проба Дьюка) закономерно увеличивается при выраженной тромбоцитопении, но остается нормальным или почти нормальным при глубоких нарушениях свертываемости крови (เช่น, при гемофилии). Эти данные, получившие полное подтверждение в дальнейших исследованиях, позволили сделать вывод, что первичный гемостаз в микрососудах осуществляется в основном за счет тромбоцитов. При этом выраженное увеличение времени кровотечения регистрируется не только при значительной тромбоцитопении (менее 30—50 Г в 1 ล.), но и при тяжелых формах качественной неполноценности тромбоцитов (тромбастения Гланцманна, тромбоцитопатии), а также при дисфункциях этих клеток вторичного генеза — из-за дефицита плазменных кофакторов адгезии и агрегации или наличия в плазме ингибиторов этих функций (парапротеинов, продуктов протеолиза и др.).
Среди наследственных форм вторичной дисфункции тромбоцитов наиболее важной и распространенной в клинической практике является ангиогемофилия (ฟอน Willebrand โรค), при которой время кровотечения увеличивается до 0,5—1 ч и более, а из приобретенных форм — нарушения функции тромбоцитов при диссеминированном внутрисосудистом свертывании крови (тромбоцитопатия потребления, повреждающее действие продуктов протеолиза), uremia, เข้ายา (แอสไพริน, antykoahulyantы, фибринолитики и др.).
Формирование тромбоцитарной пробки и остановка кровотечения из микрососудов завершается при проведении пробы Дьюка за 2—4 мин, а при создании дополнительного венозного стаза (наложение манжеты с давлением 5,3 ปาสคาล, หรือ 40 มิลลิเมตรปรอท. ศิลปะ, และอื่น ๆ) — за 6—10 мин.
Ведущая роль в реализации первичного гемостаза принадлежит адгезивно-агрегационной функции тромбоцитов (ААФТ).
В настоящее время достаточно хорошо изучены основные механизмы ААФТ, разработаны доступные лабораторно-инструментальные методики ее исследования. Чаще всего пусковую роль в этом процессе играет повреждение стенки кровеносных сосудов, вследствие чего тромбоциты вступают в контакт с субэндотелием, в частности — с главным стимулятором адгезии коллагеном, บวม, образуют отростки и приклеиваются (адгезируют) на этих участках.

Важнейшими плазменными кофакторами этого процесса являются ионы кальция и синтезируемый в эндотелии белок—ฟอน Willebrand ปัจจัย (ปัจจัย VIII: รкоф) а в тромбоцитах — взаимодействующий с фактором Виллебранда мембранный гликопротеин ฉันใน (ГП-ฉันใน).
В связи с этим дефицит фактора Виллебранда (ангиогемофилия, или болезнь Виллебранда) или ГП-Iв (тромбоцитодистрофия, или болезнь Бернара—Сулье) сопровождается резким нарушением адгезивности тромбоцитов.
Наряду с адгезией протекает процесс агрегации тромбоцитов — набухания и склеивания их между собой с образованием отростков и с наложением агрегатов на участок повреждения сосуда, в силу чего гемостатическая пробка или тромб быстро растет.
Первичный стимул к агрегации дают коллаген, выделяющийся из поврежденных стенок сосудов, и в еще большей степени АДф из гемолизирующихся в зоне повреждения эритроцитов, катехоламины и серотонин (L. 3. Баркаган, B. F. Архипов, 1980, 1983).
Из тромбоцитов, подвергающихся адгезии и агрегации, активно секретируются гранулы, которые содержат вещества, усиливающие процесс агрегации и формирующие ее вторую волну. เหล่านี้รวมถึง небелковые гранулы высокой электронно-оптической плотности, содержащие в большом количестве АДФ, ตื่นเต้น, норадреналин и серотонин, а также α-гранулы, содержащие белки — антигепариновый фактор (ปัจจัย 4), β-тромбоглобулин, тромбоцитарный стимулятор роста (митогенный фактор) และอื่น ๆ.
Позднее секретируются гранулы, содержащие лизосомальные ферменты (реакция освобождения II).
В результате взаимодействия тромбоцитарных и плазменных факторов в зоне гемостаза образуется тромбин, малые дозы которого резко усиливают и завершают процесс агрегации и одновременно вызывают свертывание крови, в силу чего тромбоцитарный сгусток покрывается фибрином, приобретает большую плотность, подвергается ретракции.
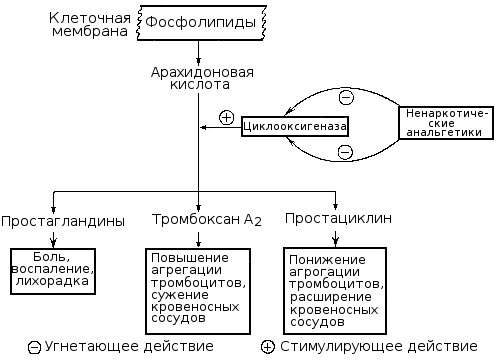
Чрезвычайно важную роль в регуляции тромбоцитарного гемостаза играют производные арахидоновой кислоты, освобождаемой из мембранных фосфолипидов тромбоцитов и стенки сосудов вследствие активации фосфолипаз.
В дальнейшем под влиянием циклооксигеназы из арахидоновой кислоты образуются prostaglandins (PGG2, PGH2), а из них в тромбоцитах под влиянием тромбоксансинтетазы вырабатывается чрезвычайно мощный агрегирующий агент — тромбоксан ก2 (TXA2), а в стенке сосудов под влиянием простациклинсинтетазы — основной ингибитор агрегации — простациклин (простагландин ฉัน2, PGI2).
Нарушение образования тромбоксана A2 в результате снижения активности или блокады циклооксигеназы или тромбоксансинтетазы ведет к выраженному нарушению функции тромбоцитов, способствует развитию кровоточивости, что наблюдается при ряде наследственных и приобретенных (симптоматических) тромбоцитопатий. Нарушение же синтеза в стенке сосудов простациклина или ослабление его поступления в кровь ведет к повышенной склонности тромбоцитов к агрегации, создает тромбогенную опасность. Продолжительность активного действия тромбоксана, простациклина и родственных им других простагландинов небольшая (ไม่กี่นาที), но значение их в регуляции и патологии гемостаза весьма велико. В результате метаболизма они превращаются в неактивные производные — тромбоксан B2 и другие конечные продукты.
ตามที่นักวิทยาศาสตร์, исследование которых легло в основу учения о простагландиновой регуляции тромбоцитарного гемостаза, этот механизм является пусковым в развитии адгезивно-агрегационной функции тромбоцитов. Активация тромбоцитарных мембран может осуществляться не только АДФ и тромбоксаном, но и гидроперекисями полиненасыщенных жирных кислот, образующимися в ходе свободнорадикального аутоокисления фосфолипидов.
Помимо перечисленных выше агентов, в тромбоцитах и в других активированных клетках крови (лейкоцитах и пр.) образуются и иные мощные стимуляторы агрегации. Из них в последние годы особое внимание уделяется фосфолипидному пластиночному агрегирующему фактору (PAF) из лейкоцитов и тромбоцитов, являющемуся 1-0-октадецил-2-ацетил-3-фосфорилхолином, а также содержащемуся в α- гранулах тромбоцитов гликопротеину G (тромбоспондин, эндогенный лектин). Этот фактор освобождается из тромбоцитов вместе с α-гранулами, фиксируется на поверхности активированных кровяных пластинок, образуя комплекс с фибриногеном, и в таком виде используется для осуществления тромбинагрегации. В силу этого при тромбоцитопатиях с отсутствием α-гранул (เช่น, при синдроме серых тромбоцитов) нарушается агрегация этих клеток под влиянием тромбина.
Для осуществления адгезивно-агрегационной функции тромбоцитов необходим ряд плазменных кофакторов агрегации — ионы кальция и магния, fibrinogen, альбумин и два белковых кофактора, именуемые агрексонами A и B, фосфолипидный кофактор и др.
Вместе с тем парапротеины, криоглобулины и продукты фибринолнза ингибируют агрегацию тромбоцитов. К белковым ингибиторам этого процесса относятся также простациклин – зависимый макромолекулярный белок, фактор Барнес—Лиана (резко снижается при тромботической тромбоцитопенической пурпуре) และอื่น ๆ.
В осуществлении агрегационной функции важную роль играют мембранные гликопротеины тромбоцитов, взаимодействующие с агрегирующими агентами.
Согласно рекомендациям Международного комитета по тромбозам и гемостазу, различают следующие основные виды мембранных гликопротеинов:
Гликопротеин I, состоящий из двух субъединиц — Ia и Ib. Первая из них является рецептором фактора Виллебранда и необходима для адгезии, а вторая — для тромбин-агрегации. Содержание гликопротеина I снижено при одной из вариантных форм ангиогемофилии и при тромбоцитодистрофия (เบอร์นาร์ดโรค-Soulier).
Гликопротеин II, также состоящий из двух субъединиц, необходим для всех видов агрегации, содержание его (особенно IIb) резко снижено при тромбоцитоастении Гланцманна.
Гликопротеин III, одни из компонентов которого соединяется с гликопротеином IIb и кальцием, необходим для большинства видов агрегации и ретракции сгустков; содержание его снижено при тромбоцитоастении Гланцманна
Функциональное значение IV и V мембранных гликопротеинов нуждается в уточнении.