ห้ามเลือดแข็งตัว – ระบบของการห้ามเลือด
แข็งตัวของเลือดเป็นกระบวนการเอนไซม์ที่ซับซ้อน, เกี่ยวข้องกับจำนวนของเอนไซม์ย่อยโปรตีน, -เอนไซม์โปรตีนและส่วนประกอบของเรียม, เร่งอย่างรวดเร็ว และทวีความรุนแรงการทำงาน และ действие ферментов.
Условно процесс свертывания крови может быть разделен на две основные фазы:
- начальную многоступенчатую, приводящую к активации протромбина (фактора II) с превращением его в активный фермент — тромбин (IIA);
- конечную, в которой фибриноген под влиянием тромбина превращается вначале в мономеры и димеры фибрина, а затем — в фибрин-полимер, ที่จะมีความเสถียร โดยใช้งานปัจจัย XIII.
ตามระบบการตั้งชื่อนานาชาติ, ปัจจัยการแข็งตัวทั้งหมด, นอกจากนี้ – เกล็ดเลือด, เขียนแทน ด้วยเลขโรมัน (ตารางที่).
Характеристика факторов свертывания крови | |||||
Цифровое обозначение | Наиболее принятые наименования | Содержание в плазме крови, g / l | Активность, % | Период полужизни в плазме крови после внутривенного введения | Минимальный уровень, необходимый для гемостаза |
| ฉัน | Фибриноген | 1.8-4.0 | – | 3—5 дней | 0,8 g / l |
| ครั้งที่สอง | Протромбин | ไปยัง 0,1 | 80—120 | 3—4 дня | 40% |
| สาม | Тканевый тромбопластин | 0 | 0 | ? | – |
| IV | แคลเซียมไอออน | 0,9—1,2 ммоль/л | – | – | – |
| วี | Ac-глобулин (проакцелерин) | ไปยัง 0,01 | 70—150 | 18—24 ч | 10-15% |
| ปกเกล้าเจ้าอยู่หัว | Проконвертин | " 0,005 | 80—120 | 4—6 ч | 5-10% |
| 8 | Антигемофильный глобулин (АГГ)
| 0,01—0,02 | 60—250 | 12-18 | 30—35% |
| ทรงเครื่อง | PTC-фактор (Plasma Thromboplastin component), кристмас-фактор | ไปยัง 0,003 | 70—130 | 20—30 ч | 20—30% |
| เอ็กซ์ | Фактор Стюарта—Прауэра | " 0,01 | 80—120 | 48—56 ч | 10—20% |
| จิน | PTA-фактор (Plasma Thromboplastin antecedent), плазменный предшественник тромбопластина | " 0,005 | 70—130 | 60 ไม่ | ? |
| สิบสอง | Фактор Хагемана, контактный фактор | ไปยัง 0,03 | 70—150 | 2- 3 วัน | น้อยกว่า 1 % |
| สิบสาม | Фибринстабилизирующий фактор (фибриназа) | 0,01-0,02 | 70—130 | 2- 3 วัน | 2-5% |
| พลาสม่า prekallikrein, фактор Флетчера | ไปยัง 0,05 | 60—150 | ? | น้อยกว่า 1 % | |
| Высокомолекулярный кининоген (ВМК), фактор Фитцжеральда, фактор Флоджека, фактор Вильямса | ไปยัง 0,06 | 80—130 | ? | น้อยกว่า 1 % | |
Для обозначения того, что эти факторы подверглись активации к, цифровым символам фактора добавляется буква «a», а в том случае; если активным действующим началом фактора становится один из его фрагментов,— буква «f»
Помимо цифрового обозначения используются и другие наименования факторов свертывания — по их функции (เช่น, фактор VIII — антигемофильный глобулин), по фамилиям больных с впервые: обнаруженным дефицитом того или иного фактора (фактор XII — фактор Хагемана, фактор X — фактор Стюарта—Прауэра และอื่น ๆ), реже — по фамилиям авторов (เช่น, ฟอน Willebrand ปัจจัย).
Свертыванию крови противодействуют ประถม (самостоятельно синтезируемые) и вторичные, образующиеся в процессе свертывания и фибринолиза физиологические антикоагулянты.
Трансформация фибриногена в фибрин
Рассмотрение процесса свертывания крови целесообразно начать с его конечного этапа, заключающегося в том, что протеолитический фермент тромбин, образующийся из своего неактивного предшественника — prothrombin, отщепляет от молекулы фибриногена четыре пептида (два пептида A и два пептида B), в результате чего образуются мономеры фибрина у каждого из которых имеется четыре свободных связи. Путем соединения этими связями мономеров друг с другом сначала парами — в димеры, а затем — в полимеры (соединения по типу «конец в конец» и «бок в бок»). формируются волокна фибрина.
Фибриноген — глобулярный гликопротеин (น้ำหนักโมเลกุล 340000), состоящий из двух одинаковых субъединиц. Каждая из субъединиц состоит из трех цепей — Aα, Bβ и γ.
Вначале тромбин отщепляет от этой молекулы пептиды A (образуя дес-A-мономеры фибрина), затем — пептиды B (дес-AB или полные мономеры фибрина). Появление свободных пептидов A в циркулирующей крови (определяются иммунологически с помощью анти-A-сыворотки) служит признаком тромбинемии и используется в качестве «свидетеля» внутрисосудистого свертывания крови (при ДВС-синдроме, массивных тромбозах).
Мономеры фибрина имеют трехнодулярную структуру, и их соединение в полимер проходит этапы формирования димеров, из которых при продольном и поперечном связывании образуются протофибриллы, а затем — волокна фибрина. Этот фибрин растворим в 5—7 М . мочевине или в 2 % монохлоруксусной кислоте, в связи с чем он обозначается как фибрин S (solubile). Под влиянием фактора XIII, который также активируется тромбином в присутствии ионов кальция, в фибрине образуются дополнительные дисульфидные связи как между γ-, так и α-цепями, что делает его. нерастворимым в мочевине— фибрин I (insolubile).
В нормальных условиях уже сравнительно умеренные концентрации тромбина (เช่น, вызывающие свертывание плазмы крови за 10—12 с) обеспечивают полную трансформацию фибриногена в фибрин, в силу чего в сыворотке крови этот белок иммунологическими и другими методами уже не определяется.
ในทางตรงกันข้าม,, при процессах, характеризующихся внутрисосудистым свертыванием крови, снижается чувствительность к тромбину и в той или иной степени нарушается процесс полимеризации мономеров фибрина, в силу чего тромбиновое время свертывания удлиняется и указанные выше пороговые дозы тромбина коагулируют уже не весь фибриноген. Нарушение это связано с тем, что часть полных и неполных мономеров фибрина образуют комплексные соединения с фибриногеном и, อาจ, с ранними продуктами расщепления фибрина и фибриногена плазмином. Эти крупномолекулярные и среднемолекулярные растворимые фибрин-мономерные комплексы (RFMK), обозначаемые в литературе так же как «плохо свертывающийся фибрин», «заблокированный фибриноген», плохо коагулируют под влиянием тромбина (обладают относительной тромбин-резистентностью), но образуют гель при добавлении к плазме 50 % เอทานอล (этаноловый тест), некоторых образцов протамин-сульфата, раствора β-нафтола в 50 % แอลกอฮอล์, кислого ортофенантролина.
Феномен неферментной коагуляции РФМК (заблокированного фибриногена) ที่เรียกว่า феномен паракоагуляции и широко используется в лабораторной диагностике тромбинемии и внутрисосудистого свертывания крови. Наиболее полно выявить эти комплексы позволяют следующие тесты:
- коагуляционная проба с ядом среднеазиатской змеи эфы;
- проба с ортофенантролином;
- การยึดเกาะของเชื้อทดสอบ.
ดังนั้น, трансформация фибриногена в фибрин может идти как обычным путем, так и с образованием РФМК (продуктов паракоагуляции), выявление которых имеет важное значение для диагностики внутрисосудистого свертывания крови.
Общая оценка конечного этапа процесса свертывания проводится с помощью тромбинового теста, เสื้อ. มันคือ. путем определения времени свертывания цитратной плазмы при добавлении к ней стандартного количества тромбина. Тест имеет большое значение для диагностики многих нарушений свертываемости крови, его результаты важны для правильного толкования показаний всех других коагуляционных проб, ибо торможение конечного этапа процесса удлиняет время свертывания во всех остальных исследованиях.
Механизмы трансформации протромбина в тромбин
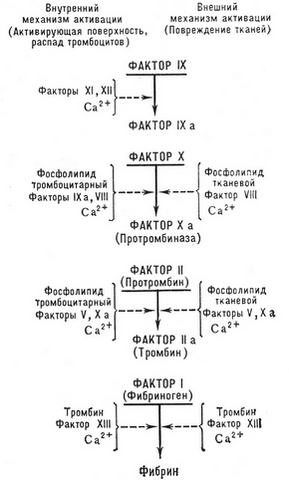
Согласно современной каскадно-комплексной теории свертывания крови, активация протромбина (фактора II) является результатом многоступенчатого ферментного процесса, в котором последовательно активируются и взаимодействуют между собой различные факторы свертывания. Из них факторы III, ปกเกล้าเจ้าอยู่หัว, เอ็กซ์, ทรงเครื่อง, XII и XI, а также прекалликреин являются протеолитическими ферментами, а факторы VIII, V — неферментными акцелераторами процесса, ускоряющими активацию ферментных факторов во много тысяч раз.
Различают два основных механизма запуска процесса свертывания – внешний и внутренний.
Внешний механизм свертывания крови
Внешний механизм свертывания крови запускается тканевым тромбопластином, который может попадать в плазму крови из поврежденных (ความเสียหาย, операции и др.) เนื้อเยื่อ, стенок сосудов (вырабатывается поврежденным эндотелием при участии активированных тромбоцитов), а также поступать в кровоток с тканевой жидкостью (эмболия околоплодными водами, перитонеально-венозное шунтирование, различные виды шока). Непосредственно в крови тканевый тромбопластин может продуцироваться активированными моноцитами (под влиянием эндотоксина, иммунных комплексов и т. d).
В большом количестве тканевый тромбопластин вырабатывается и клетками некоторых злокачественных опухолей (в том числе лейкозными).
Действующим началом тканевого тромбопластина является белок — апопротеин ค, тогда как фосфолипидная часть фактора III неспецифична и выполняет роль активирующей процесс матрицы (เสื้อ. มันคือ. функционально сходна с фактором 3 เปลทเล็ท, кефалином, эритрофосфатидом).
Из схемы свертывания крови видно, что тканевый тромбопластин образует комплекс с ионами кальция и фактором VII, активирует последний, в результате чего образуется мощный ферментный активатор фактора X.
В лабораторных условиях внешний механизм имитируется тестом протромбинового времени, при выполнении которого к рекальцифицированной цитратной плазме добавляется извне тканевый (чаще всего из мозга человека или кролика) тромбопластин определенной активности и регистрируется время свертывания.
Внутренний механизм свертывания крови
Внутренний механизм значительно более сложен и важен для расшифровки патогенеза и диагностики наиболее часто встречающихся в клинической практике геморрагических диатезов — гемофилий A и B, ангиогемофилии, или болезни Виллебранда (на их долю приходится более 97 % всех наследственных геморрагических коагулопатий).
При внутреннем механизме свертывание крови (พลาสมา) реализуется без участия тканевого тромбопластина.
Пусковым фактором этого механизма является фактор XII (Хагемана), активация которого происходит вследствие контакта крови либо с чужеродной поверхностью (стеклом, металлом, каолином и т. d), либо с субэндотелием (коллагеном) и другими компонентами соединительной ткани, что наблюдается при повреждении стенок кровеносных сосудов (механических травмах, васкулитах, атеросклерозе и т. d).
นอกเหนือจาก, активация фактора XII может осуществляться путем его ферментативного расщепления (калликреином, плазмином или другими протеазами). ด้วยเหตุนี้, возможны два вида активации фактора XII:
- และ) контактный — с образованием фактора ХIIа;
- ไปยัง) ферментный — с образованием активного фрагмента фактора XII (ХIII).
Имеются определенные качественные различия между действием факторов XIIa (в большей степени влияет на свертывание) и XIII (оказывает большее активирующее влияние на калликреин-кининовую систему и фибринолиз). В целом же фактор XII является универсальным активатором всех плазменных протеолитических систем — свертывающей, калликреин-кининовой, фибринолитической и системы комплемента.
В начальной (контактной) фазе процесса свертывания происходит, ด้านเดียว, взаимная активация фактора XIIa и калликреина в комплексе фактор XII — прекалликреин — высокомолекулярный кининоген, а затем — активация фактора XI в комплексе факторов XIIa — XI — ВМК.
Этот начальный этап наиболее длительный (4/5 ตลอดเวลาการแข็งตัว), активируется с нарастанием площади и продолжительности контакта крови с чужеродной поверхностью (минимальна активация при силиконировании посуды и более быстром проведении исследования после взятия крови из вены, максимальна — при добавлении каолина). Важно учитывать, что контактная активация факторов XII и XI происходит в стабилизированной цитратом или оксалатом крови и плазме, เสื้อ. มันคือ. не нуждается в ионах кальция. Участие кальция в свертывании крови начинается лишь с момента активации фактора IX, เสื้อ. มันคือ. образования следующего комплекса 2.
При создании максимального контакта каолином и достаточном количестве фактора 3 тромбоцитов или кефалина (เสื้อ. มันคือ. в активированном парциальном тромбопластиновом тесте) ослабление активации фактора XI и замедление свертывания может быть вызвано дефицитом факторов XII, จิน. prekallikreina, высокомолекулярного кининогена (ВМК). Чаще всего встречается дефицит фактора XI, остальные нарушения наблюдаются крайне редко.
Значительно чаще нарушение внутреннего механизма свертывания связано с дефектом следующего этапа — активации факторов IX и VIII. มักจะ, это связано с дефицитом компонентов фактора VIII, เสื้อ. มันคือ. с гемофилией A и ангиогемофилией или болезнью Виллебранда (เกี่ยวกับ 93 % ผู้ป่วยทุกราย), реже — с дефицитом фактора IX (гемофилией B).
Большое значение для клиники фактора VIII требует более детального рассмотрения данных о его структуре и функции.
ตามข้อมูลปัจจุบัน, фактор VIII является белковым полимером, состоящим из ряда одинаковых субъединиц. В каждой из субъединиц имеются следующие компоненты:
1) коагуляционная часть (8: จาก) и ее антиген (8: САг);
2) ฟอน Willebrand ปัจจัย (FV) или кофактор ристомициновой агрегации тромбоцитов (8: FV, 8: Pкоф) и его антиген (8: РАг, 8: РАг /ФВ);
3) углеводная часть и, บางที, еще один неидентифицированный белковый компонент.
Место синтеза VIII:จาก точно не установлено, контролируется этот синтез геном, находящимся в Х-хромосоме; изолированное нарушение его характерно для гемофилии А.
Синтез фактора Виллебранда (FV) контролируется аутосомно и происходит практически только в эндотелии, вследствие чего этот фактор используется в качестве маркера эндотелия; его уровень в крови резко повышается при многих сосудистых заболеваниях.
Дефицит фактора Виллебранда или изменение его мультимерной структуры вызывает как нарушение сосудисто-тромбоцитарного гемостаза (มีเลือดออกเป็นเวลานาน, การละเมิดยึดเกาะเกล็ดเลือดการรวมตัวของเกล็ด เลือด ristomicin หรือแก้ว และคอลลาเจน), และการลดลงของกิจกรรม VIII:จาก. การละเมิดเหล่านี้เกิดขึ้นในชุดที่แตกต่างกันในรุ่นต่าง ๆ angiogemofilii. ในเลือด พลาสม่าประกอบด้วย VF ทั้งสอง, และเกล็ดเลือด (ในα-เม็ด), причем внутри этих клеток он разобщен с VIII:จาก. При гемофилии A уровень VIII:С резко снижен, тогда как содержание в плазме VIII:ФВ остается нормальным.
ปัจจัยที่ 8:จาก — неферментный акцелератор фактора IXa, с которым он образует комплекс на фосфолипидной матрице. Активируется VIII:С по принципу обратной связи малыми дозами тромбина (IIA) และ, บางที, фактором Xa; при этом он диссоциирует с ФВ. Вслед за активацией тромбин расщепляет и инактивирует фактор VIII:С как прямо, так и косвенно путем активации протеина С.
Взаимодействие внешнего и внутреннего механизма свертывания крови
В организме внешний и внутренний механизмы активации свертывающей системы крови не разобщены, а интимно взаимодействуют друг с другом. ดังนั้น, факторы XII + калликреин активируют фактор VII. Существенную роль играют также взаимная активация факторов VIIa и IXa, а также VIIa и Xa.
Фактор VIIa частично активируется также плазменными липопротеинами и триглицеридами, а ретроградно тромбином. В силу этого выявление активации и повышения уровня фактора VIIa служит глобальным маркером внутрисосудистой активации системы свертывания крови и высокого тромбогенного риска, особенно при ишемической болезни сердца и гиперлипидемиях.
Как при внешнем, так и при внутреннем механизмах свертывания взаимодействие и активация факторов осуществляются на фосфолипидных микромембранах, служащих матрицами, на которых фиксируются (с помощью ионов кальция), เปลี่ยนแปลงโครงสร้าง četvertičnuû และตติย, ทำปฏิกิริยากับแต่ละอื่น ๆ อย่างโปรตีนปัจจัย. บทบาทของเมทริกซ์ดังกล่าวดำเนินการเยื่อเยื่อและเม็ดของเกล็ดเลือด (ปัจจัย 3 เปลทเล็ท) และส่วนที่คล้ายกันของเยื่อหุ้มเซลล์อื่น ๆ (เซลล์เม็ดเลือดแดง ฯลฯ). ในระดับใหญ่ กำหนดเมทริกซ์เมมเบรนนี้เรียม, что при прочих равных условиях период свертывания плазмы, ที่มีจำนวนเล็ก ๆ ของเกล็ดเลือด, более продолжительный, чем время свертывания плазмы с нормальным количеством тромбоцитов, แล้วก็, อะไร gemoliz (освобождение эритроцитарных мембран) очень ускоряет свертывание и искажает показания коагуляционных тестов (делает гемолизированную кровь непригодной для исследования свертывающей системы крови).
В силу неодинаковых условий фосфолипидной активации показания нестандартизированных коагуляционных тестов подвержены очень большим случайным колебаниям. Этот разброс еще более возрастает из-за неодинаковой по интенсивности (свойства стекла пробирок) и продолжительности контактной активации фактора XII. Стандартизация коагуляционных тестов по контакту (การรับ และการประมวลผลเลือด ในเงื่อนไขของ silikonirovaniâ ห้องปฏิบัติการเครื่องแก้ว หรือท่อ fluoropolymer กับตที่ตามมาเปิดใช้งานสูงสุดของขั้นตอนการติดต่อของดินขาว) и по фосфолипидной активации (добавление стандартных количеств кефалина) делает их намного более точными и воспроизводимыми.
ไปยัง оценки свертывающей активности тромбоцитов следует сравнивать каолиновое время свертывания плазмы с высоким и низким содержанием тромбоцитов (исключив из реакции кефалин).
ดังนั้น, полная оценка процесса свертывания при запуске его по внутреннему механизму осуществляется с помощью исследования общего времени свертывания крови стандартизированными тестами — каолиновым и каолин-кефалиновым (เปิดใช้งานเวลา thromboplastin บางส่วน), เช่นเดียวกับการทดสอบสองขั้นตอน autokoagulâcionnym.
Аналогичным образом активируется и инактивируется другой неферментный акселератор свертывания — фактор V, взаимодействующий с фактором X. Этот комплекс именуется в литературе протромбиназой (по устаревшей терминологии — кровяной тромбопластин), в которой активной ферментной частью является фактор Xa, трансформирующий протромбин в тромбин. На фосфолипидной матрице (เช่น, на мембране тромбоцита) активность этого комплекса в 1000 ครั้งที่สูงขึ้น, чем при отсутствии фосфолипида. Комплекс же Va—Xa в 3000 เวลาใช้งานมากขึ้น, чем фактор Xa. ดังนั้น, ปัจจัย Va และเมทริกซ์ fosfolipidnaâ กันเพิ่มกิจกรรมของ prothrombin พื้นฐานเมื่อเทียบกับปัจจัยแยก Xa 300000 เวลา.
บนพื้นผิวของแต่ละเกี่ยวกับ thrombocyte 3000 фосфолипидных рецепторов к комплексу Va—Xa, из них около 1000 рецепторов высокоаффинных. เมทริกซ์การคอมเพล็กซ์ทั้งหมดของปัจจัยการแข็งตัวสามารถทำหน้าที่เป็น mikromembrany kefalina และเรียมเยื่อของเม็ดเลือดแดง (èritrocitin, èritrofosfatid), ที่ถูกใช้ในห้องทดลอง.
เมื่อเปิดใช้ Xa ปัจจัย prothrombin กลายเป็น Thrombin αที่ใช้งานอยู่. จากนั้นอย่างต่อเนื่องหยุดชะงักส่วน 1 และยังคง pretrombin 1, แล้วส่วน 2 และยังคง pretrombin 2. เมื่อโมเลกุลนี้ odnocepočnaâ แยกแปรสภาพ prothrombin dvuhcepočnuû (กลุ่ม A และ B) α-Thrombin ของโมเลกุล. Затем последний подвергается аутолизу и утрачивает активность, а также инактивируется физиологическими антитромбинами.
Под влиянием других эндо- и экзогенных (яды змей и пр.) เอนไซม์ย่อยโปรตีน สามารถผลิตฟอร์ม Thrombin, แตกต่างจากα-Thrombin กิจกรรมอ่อนในแข็งตัว, ความไวน้อยกว่าเฮ Antithrombin III และคุณสมบัติอื่น ๆ.
แคลเซียมไอออนเป็นสิ่งจำเป็นสำหรับการแข็งตัวของเลือด, ร่วมทำการต่อไปนี้:
- โครงสร้างโมเลกุลของปัจจัยการแข็งตัวในแบบฟอร์มที่ใช้งานอยู่;
- ปัจจัยตรึงการปฏิสัมพันธ์ในเมตริกซ์เรียม;
- เร่งการทำงานของแต่ละปัจจัย โดยการภาคยานุวัติ (เช่น, การเปลี่ยนแปลงของ protrombina ใน trombin เร่ง Ca ++ 1000 ครั้ง โดยการแนบไปตกค้างγ karboksiglûtamilovym ใน NH2-ส่วนขั้วของโมเลกุล).
เมื่อวิเคราะห์ผลการทดสอบหลักการแข็งตัว มันเป็นสิ่งสำคัญที่ต้องพิจารณาต่อไปนี้:
- ในระบบทดสอบ (VII) ปัจจัยเกี่ยวข้องกับเฉพาะเครื่องจักรกระบวนการภายนอก, ดังนั้น เมื่อของขาดจะขยายเพียงประมาณ- Thrombin ครั้ง;
- факторы XII, จิน, ทรงเครื่อง, (VIII) และ precallycreine เข้าร่วมในกลไกการเปิดใช้งานภายใน, การขาดดุลที่ละเมิดและ APTT, ในขณะเวลา prothrombin ยังคงปกติ;
- ที่ขาดของปัจจัย X, วี, (๒) และ (I), ที่ปิดทั้งสองกลไกการแข็งตัว, พยาธิที่พบในการทดสอบข้างต้น.
อย่างไรก็ตาม กลไกภายใน และภายนอกของการเปิดใช้งานจะไม่แยกจากกัน, โต้ตอบ.
ดังนั้น, ระบุเปิดใช้งานร่วมกัน ของปัจจัย VII และปัจจัย IX และ X, เช่นเดียวกับการทำงานของปัจจัย VII ซับซ้อน XIIa-kallikrein-WMC. รวมของสะพานเหล่านี้ระหว่างกลไกภายใน และภายนอกเป็นเกณฑ์วินิจฉัยของแข็งตัว intravascular แฝง หรือรัฐ predtrombotičeskogo. บันทึกเทปให้เพิ่มกิจกรรมของปัจจัย VII ในพลาสมาเมื่อทดสอบในพลาสม่า, ไร้ปัจจัยนี้, รวมทั้งใช้การทำงานแป้งเย็นของ prothrombin เวลาวัว tromboplastinom.
หลายปัจจัยการแข็งตัวและละลายลิ่มเลือดมีสังเคราะห์ในตับ. ปัจจัยเหล่านี้ที่สอง, ปกเกล้าเจ้าอยู่หัว, X และ IX, เช่นเดียวกับโปรตีนแข็ง C และ S K- vitaminozavisimy: ขั้นตอนสุดท้ายของการสังเคราะห์ของพวกเขา (carbauxilirovanie) เกิดที่ fillohinonov ขาด (วิตามินเค) และอยู่ภาย ใต้อิทธิพลของคู่อริของเขา — coumarins, fenilina เป็นต้น. เมื่อนี้ไม่ก่อตัวในเซลล์ตับ K-vitaminozavisimoj karboksilazy, ที่ deprives พวกเขามีความสามารถในการเปิดใช้งานปัจจัยการแข็งตัว. อธิบายการ Diathesis โรคทางพันธุกรรม, ซึ่งเป็นผลมาจากการฝ่าฝืนนี้ carboxylation สังเคราะห์ ทั้งหมดลดลงปัจจัยการแข็งตัวของ K-vitaminozavisimyh.
ในทางตรงกันข้าม,, ตัว V และคอมโพเนนต์ต่าง ๆ ของระบบการละลายลิ่มเลือดและ kallickrein-kininova จะสังเคราะห์ในตับ ไม่ว่า fillohinonov.
