Mekanismen för verkan av läkemedel
I de flesta fall,, läkemedelssubstans (ligand) Den hade sin effekt, Det måste uppfylla kroppens specifika komponenter - målreceptorer, molekylstruktur, representerar ett protein, mindre nukleinsyra, lipid eller andra konfigurationer, anordnade inuti eller på ytan av celler, med vilka det interagerar, utlöser en kedja av biokemiska och fysikalisk-kemiska processer, vilket leder till vissa effekter.
Det finns två typer av membranreceptorer - jonkanaler och receptorer, associerad med G-proteinet. Till Exempel, för adetilholina och liknande läkemedel kännetecknas av natriumkanal. Acetylkolin reagerar med kanalproteinet, vilket orsakar en konformationsförändring i den, som bidrar till öppnandet av kanalen och penetreringen av natriumjoner in i cellen. Denna process är grunden för nervös spänning. Vissa läkemedel, interagerar med proteinet av natriumkanalen, förhindra dess öppning, därigenom blockera överföringen av nervexcite.
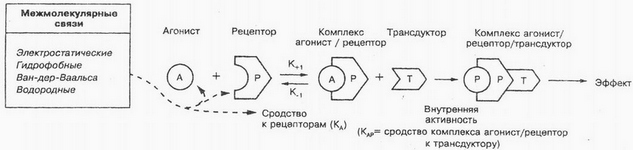
Till den inre delen av plasmamembranet hos celler ansluter sig till så kallade G-protein-, vilket ger synkronisering av interaktionen av läkemedlet med den samtidiga aktiveringen av de respektive intracellulära målproteiner. Såsom visas i fig, läkemedelsmolekylen interagerar med receptorn (P) på den yttre ytan av membranet, vilket orsakar en konformationsändring i receptorproteinet. Med denna G -belok förändrar sin rumsliga struktur, migrerar till planet av membranenzymer, som är inaktiva inne i cellen. G Protein interaktion med enzymer (T) deras aktiverings orsaker (EUR / P / T). Noradrenalin, dopamin och andra ligander interagerar med receptorema är, av G--proteins. Det bör noteras, att acetylkolin kan interagera inte bara med kanalproteinet, och receptorer, av G--proteins.
Avseende på förekomst av interaktionen mellan liganden och det är nödvändigt att bioreceptors, att de har komplimentarnostyu, det vill säga mellan dem måste det finnas en viss samhörighet, eller affinitet (rördimensioner, rymdkonfiguration, förekomsten av motsatta laddningar, etc.. d.). Till Exempel, den positiva laddningen hos exogen ligand måste överensstämma med den negativa laddningen av receptorn, radikaler och opolära ämnen kan binda till hydrofoba regioner i receptorn.
Bland de fysikalisk-kemiska egenskaperna hos läkemedelssubstanser, påverka deras interaktion med receptorer, bör lyfta fram värdet av molekylen, enligt vilken en substans kan samverka med hela receptorn eller dess del. Från storleken av molekylen av läkemedlet beror på kinetiken för penetrering det genom biologiska membran. Typiskt med storleken hos molekylen ökar dess flexibilitet och möjlighet till bildning av van der Waals bindningar med den makromolekylära partnern. Förutom, viktiga stereokemi läkemedelsmolekyl. Från, i varje isomer form är ett läkemedel, Det beror på dess farmakologiska aktivitet. Och det måste ha i åtanke: desto svårare konformationen hos receptormolekylen, ju större skillnaden i effekten av stereoisomerer.
Interaktion läkemedel - receptor på bekostnad av intermolekylära bindningar. Första materialet attraheras till receptorn via elektrostatiska krafter, och i närvaro av komplementaritet - utgör en receptor kommunikation med hjälp av fysiska och fysikalisk-kemiska interaktioner (typisk för droger, som utsöndras från kroppen i oförändrad form eller maloizmenennom) eller kemiska interaktioner (inneboende i föreningarna, som genomgår kemiska reaktioner i kroppen). De flesta svaga van der Waals krafter är involverade i att bestämma specificiteten av interaktionen av läkemedlet med biokemiska raketsystem. Vätebindningar är involverade i arbetet med att erkänna och fästmaterial (Ligand) till biostructures. Jonbindningar förekomma när, När läkemedelssubstansen innehåller en katjonisk eller anjonisk grupp, och motstående strukturer är bioreceptors. Ofta jonbindningar bildas i de första stadierna av reaktionen mellan farmakologiska medel och receptorer. I sådana fall är läkemedlet reversibel. Det är viktigt för bildandet av samordning kovalenta bindningar. Med sitt deltagande, samspelet mellan alkyleringsmedlen vidare med biosubstrates, samt läkemedel och motgifter med metaller i bildning av stabila komplex, kelater, t.ex, unitiola arsenik eller tetatsin kalcium med bly. Verkan av dessa substanser är irreversibel.
Förutom, det finns en hydrofob interaktion. Även om energi sina obligationer är liten, bilda ett stort antal långa alifatiska kedjor leder till stabila system. Hydrofoba interaktioner spelar en roll för att stabilisera de konformationer av biopolymerer och bildningen av biologiska membran.
Aminosyrarester i en proteinreceptormolekyler innehåller polära och icke-polära grupper, att bestämma bildningen av polära och icke-polära bindningar mellan dem och läkemedelssubstanser. De polära grupper (-ÅH, -NH, KUTTRA-, -N3H, = O) tillhandahålla utbildning, huvudsakligen, joniska och vätebindningar. Opolära grupper (väte, metyl, cykliska radikaler etc ..) bilda hydrofoba bindningar med lågmolekylära läkemedelssubstanser.
Sålunda, läkemedelsinteraktioner med specifika receptorer kan utföras genom olika kemiska bindningar, med olika styrka. Så, ungefärliga styrka curariform ämnen holinoretseptorami elektro (jon) interaktion är 5 kcal / mol, jon-dipol - 2-5 kcal / mol, dipol-dipol - 1-3 kcal / mol, vätebindningar - 2-5 kcal / mol, Van der Waals bindningar - 0,5 kcal / mol, hydrofoba bindningar - 0,7 kcal per CH2-grupp. Minskning av bindningsstyrkan, beroende på avståndet mellan atomer för elektrostatisk växelverkan av r-2, jon-dipol - r-3, диполь-дипольного - r-4, vätebindningar - r-4, Van der Waals bindningar - r-7. Sådan kommunikation får kränkas, säkerställa reversibilitet verkan av läkemedel. Är mer hållbara kovalenta bindningar, som ger långsiktiga och ofta irreversibla effekter av ämnen, t.ex, alkiliruyushtih protivoopuholevыh preparatov. De flesta läkemedel binder reversibelt till receptorer. Vari, vanligen, vilken typ av anslutning är mycket komplex: Det kan delta samtidigt ion, dipol-dipol, van-der-vaal'sovye, hydrofoba och annan kommunikation, som till stor del bestäms av det kompletterande materialet och receptor, respektive, deras grad av konvergens mellan dem.
Styrkan av bindning av substansen till receptorerna kallas "affinitet". Ämnen, verkar på samma receptorer, kan ha relativt denna varierande grad av affinitet. Således substanser med högre affinitet kan förskjuta material med mindre affinitet hos föreningarna till receptorer. För att bestämma jämvikten mellan de "ockuperade" receptorer (Dr), fri receptor och fri agent ((D)) begagnade dissociationskonstant (K(D)), som definieras med följande formel:
K(D)=[(D)]*[R]/[ Dr]
Otritsatyelinyi log K(D) (pR(D)) Det är ett tecken på samhörighet. För att karakterisera affiniteten används ofta indikator av PD2, t. det är. otritsatyelinyi log EG50, (koncentration av substansen, i vilken den orsakar effekten, komponent 50% den maximala effekten).
En mängd olika kemiska bindningar för samarbete och ojämlik styrka, eller affinitet mellan ligander och bioreceptors förklarar den komplexa strukturen av läkemedel, innehållande olika reaktiviteter med radikaler och flerdimensionell volymetriska formen, samt komplexiteten i de processer av interaktion, ofta förekommer i flera steg (Fas): bildningen av komplexet drogen - receptor; intramolekylär gruppering; dissociation av komplexet.
Sålunda, farmakologisk effekt kan orsaka endast ämnen med en uttalad affinitet för bioreceptors. Выраженность эффекта зависит от концентрации лекарственного вещества и общего числа рецепторов.
Если вещества обладают достаточной внутренней активностью, то их называют агонистами. Под внутренней активностью понимают способность агонистов вызвать биологический эффект путем изменения конформации рецепторов, t. det är. способность лиганда активировать рецептор. Это явление рассматривается как сродство комплекса агонист—рецептор к транедуктору, превращение внешних сигналов во внутренние получило название транедукции. Внутриклеточная передача сигнала лежит в основе таких процессов, как сокращение мышечных волокон, клеточное деление, spridning, дифференциация и др. Det är nu etablerad, что ко многим веществам (гормонам, биоактивным пептидам, нуклеотидам, стероидам, низкомолекулярным биорегуляторам и др.) клетка имеет специфичные рецепторы. В результате взаимодействия указанных веществ с этими специфичными рецепторами образуются вторичные мессенджеры (посредники), которые запускают каскад биохимических реакций.
Существует понятие «частичные агонисты» — лекарственные вещества, att, связываясь с рецепторами, не дают максимального эффекта. Это непонятное явление предположительно объясняется неполной (меньшей) зависимостью сродства комплекса лекарственное вещество — рецептор к транедуктору. Till Exempel, частичный агонист опиатных рецепторов налорфин действует аналогично полному агонисту этих рецепторов морфину, хотя и слабее последнего. В то же время при совместном их применении налорфин ослабляет или устраняет эффекты морфина; särskilt, устраняется угнетающее действие морфина на дыхание. Изопреналин — это истинный агонист, а преналтерол — частичный агонист для β-адренергических рецепторов. Согласно рецепторной теории, истинный агонист может индуцировать максимальный ответ, даже если он взаимодействует лишь с частью рецепторов.
Специфические рецепторы могут иметь одни и те же или разные места связывания для агонистов и антагонистов. Возможны разные места связывания для разных агонистов. Isåfall, когда агонист и антагонист имеют одни и те же места связывания и блокирующее действие антагониста на рецептор полностью устраняется при повышении концентрации агониста (достигается максимальный эффект агониста), отношения между антагонистом и агонистом обозначают как конкурентный антагонизм. Если места связывания для агониста и антагониста различны, то отношения между ними определяют как неконкурентный антагонизм. Для характеристики антагонистов часто используют показатель pA2 (отрицательный логарифм молярной концентрации антагониста, при которой для получения стандартного эффекта агониста его концентрацию надо увеличить вдвое).
В условиях целого организма агонисты и антагонисты вызывают изменения тех или иных физиологических функций. Действие антагонистов при этом определяется тем, что они препятствуют влиянию на специфические рецепторы соответствующих естественных лигандов (t.ex, антагонист M-холинорецепторов атропин препятствует действию их агониста ацетилхолина). Förändringar, которые непосредственно связаны с взаимодействием веществ со специфическими рецепторами, обозначают термином «первичная фармакологическая реакция, которая может быть началом целой серии реакций, приводящих к стимуляции или угнетению определенных физиологических функций».
Изменения функций органов или систем (t.ex, изменения силы и частоты сердечных сокращений, тонуса гладких мышц внутренних органов, секреции желез, BP och andra.), вызываемые лекарственным веществом, обозначают как фармакологические эффекты данного вещества. Så, для сердечных гликозидов первичной фармакологической реакцией является угнетение активности транспортной Na+, К-АТФ-азы волокон миокарда, которая расценивается в качестве возможного специфического рецептора для сердечных гликозидов. В связи с этим нарушается поступление K+ в мышечные волокна и выход из волокон Na+, увеличивается содержание Ca2+ в цитоплазме, что способствует взаимодействию актина и миозина. Результатом указанных изменений является увеличение силы сердечных сокращений, что является основным фармакологическим эффектом сердечных гликозидов.
Продолжительное воздействие агонистов на специфические рецепторы нередко сопровождается снижением их чувствительности. Последняя может быть связана с изменением рецепторов, уменьшением их количества (плотности) или нарушением процессов, которые следуют за возбуждением рецепторов. При этом фармакологические эффекты агонистов становятся менее выраженными.
Sålunda, фармакологические эффекты большинства лекарственных веществ связаны с их воздействием на соответствующие специфические рецепторы.
Вещества с высоким сродством к биорецептору и низкой внутренней активностью называют антагонистами, или блокаторами, так как они, не вызывая изменений конформации биорецептора, препятствуют взаимодействию с ним эндогенных и/или экзогенных лигандов-агонистов. Существуют и так называемые «вторичные или немые рецепторы, с которыми лекарственные вещества связываются, но фармакологического действия не оказывают. Такие «немые» рецепторы наиболее часто присутствуют в белках и плазме крови (но могут находиться и в тканях). Соединение с «немыми» рецепторами приводит к снижению концентрации свободного лекарственного вещества, а значит и к снижению лечебного эффекта.
Многочисленные современные теории, объясняющие механизм взаимодействия лиганд—рецептор, состояние самих рецепторов, отсутствие пропорциональности между числом занятых рецепторов и конечной реакцией, изменение эффективности передачи сигнала и существование резервных рецепторов и частичных агонистов и т. d. легли в основу представлений о механизме действия представителей различных групп лекарственных веществ. Эти взаимодействия подразделяются на взаимодействие с рецепторами и химическое взаимодействие.
Механизм взаимодействия лекарственных веществ с биорецептором можно изобразить в виде следующей схемы: каждый лиганд (лекарственное вещество или физиологический субстрат) связывается со специфическим участком на определенном рецепторе. Активизированные рецепторы прямо или опосредованно регулируют потоки ионов (1) и/или другие внутриклеточные процессы (секрецию или мышечное сокращение) или активирует систему гуаниннуклеотидсвязывающих белков (G-белков), va, i sin tur, усиливает активацию системы второго посредника-фермента. В цитоплазме функционируют несколько разных вторых посредников, активизирующих различные белки-мишени, например протеин- киназы. Последние действуют на специфические субстраты и опосредуют фармакологический эффект.
Из представленного описания видно, что действие лекарственных веществ осуществляется по следующим механизмам:
- физиологические функции ткани (t.ex, сократительная, секреторная) могут регулироваться несколькими рецепторами, och sålunda, и различными лигандами;
- между взаимодействием лекарственного вещества с рецептором и ответом ткани или органа может существовать несколько промежуточных этапов, в частности активация связанных с рецепторами систем вторых посредников;
- эффективность механизмов, отвечающих за последовательность стимул—реакция, а также плотность рецепторов могут изменяться от ткани к ткани.
Терапевтический эффект некоторых лекарственных веществ обусловлен их прямым (не связанным со специфическими рецепторами) химическим взаимодействием с эндогенными соединениями или другими механизмами взаимодействия (Osmotiska trycket, adsorption). Так для осмотических диуретиков — маннитола, мочевины — не существует специфических рецепторов. Эти вещества повышают осмотическое давление в почечных канальцах, вследствие чего нарушается реабсорбция воды и увеличивается диурез. Со специфическими рецепторами не связано действие адсорбирующих веществ, кислотообразующих диуретиков.
Antacida (t.ex, алюминия или магния гидроксиды) реагируют с соляной кислотой с образованием продуктов со слабовыраженными кислотными свойствами. Хелатирующие агенты, связываясь с некоторыми металлами, образуют неактивные химические комплексы.
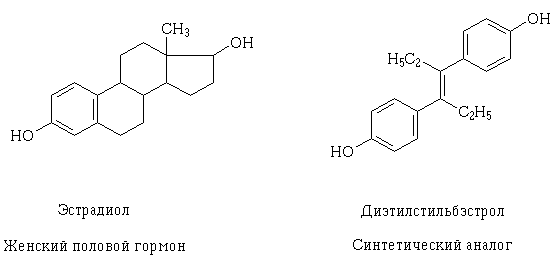
По мере углубления знаний о структуре рецепторов и механизме возможного фармакодинамического взаимодействия лекарств на клеточном уровне стало возможным целенаправленное их создание, а также объяснение, почему подобным действием могут обладать лекарственные вещества, отличающиеся, на первый взгляд, своей структурой. Примером такого явления могут служить эстрадиол и трансизомер диэтилстильбэстрола — синтетический аналог женского полового. Их структурные молекулы разные, но содержат одинаковые по свойствам и размерам функциональные оксигруппы, сходно расположенные и ориентированные в пространстве, благодаря чему молекулы этих веществ могут взаимодействовать с одним и тем же рецептором и оказывать сходное фармакологическое действие.
Способы, которыми лекарственные вещества вызывают те или иные фармакологические эффекты, обозначают термином «механизмы действия». Это понятие используют для объяснения действия лекарственных веществ на молекулярном, органном и системном уровнях. Till Exempel, механизм действия антихолинэстеразных средств на молекулярном уровне сводится к блокаде ацетилхолинэстеразы путем взаимодействия с ее анионным и эстеразным центрами. På samma gång, объясняя механизм гипотензивного действия антихолинэстеразных средств, указывают в качестве причины этого эффекта брадикардию и расширение сосудов, t. det är. рассматривают механизм данного эффекта на органном уровне.
Исследования механизмов действия лекарственных веществ ведутся постоянно, причем представления о механизме действия того или иного лекарственного вещества по мере получения новых данных могут не только становиться более детальными, но и существенно изменяться.
