Koagulasjonshemostase – Systemet med hemostase
Blodkoagulering er en kompleks enzymatisk prosess, som involverer en rekke proteolytiske enzymer, samt ikke-enzymatiske protein- og fosfolipidkomponenter, kraftig akselererende og forsterkende aktivering og enzymvirkning.
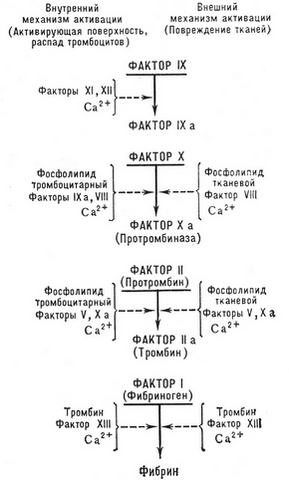
Konvensjonelt kan prosessen med blodkoagulasjon deles inn i to hovedfaser:
- innledende flertrinn, fører til aktivering av protrombin (faktor II) med sin transformasjon til et aktivt enzym - trombin (IIa);
- endelig, der fibrinogen, under påvirkning av trombin, først omdannes til fibrinmonomerer og -dimerer, og deretter til fibrin-polymer, som er stabilisert av aktivert faktor XIII.
I henhold til internasjonal nomenklatur, alle koagulasjonsfaktorer, unntatt – blodplater, angitt med romertall (i bordet).
Kjennetegn på blodkoagulasjonsfaktorer | |||||
Digital betegnelse | Mest aksepterte titler | Innhold i blodplasma, g / l | Aktivitet, % | Plasmahalveringstid etter intravenøs administrering | Minimumsnivå, nødvendig for hemostase |
| Jeg | Фибриноген | 1.8-4,0 | – | 3—5 дней | 0,8 g / l |
| II | Протромбин | Til 0,1 | 80—120 | 3—4 дня | 40% |
| III | Тканевый тромбопластин | 0 | 0 | ? | – |
| IV | Kalsiumioner | 0,9—1,2 ммоль/л | – | – | – |
| V | Ac-глобулин (проакцелерин) | Til 0,01 | 70—150 | 18—24 ч | 10-15% |
| VII | Проконвертин | " 0,005 | 80—120 | 4—6 ч | 5-10% |
| VIII | Антигемофильный глобулин (АГГ)
| 0,01—0,02 | 60—250 | 12—18 s. | 30—35% |
| IX | PTC-фактор (Plasma Thromboplastin component), кристмас-фактор | Til 0,003 | 70—130 | 20– 30 timer | 20—30 % |
| X | Stewart-Prower faktor | " 0,01 | 80—120 | 48– 56 timer | 10—20 % |
| XI | PTA faktor (Plasma Tromboplastin antecedent), plasmaforløper for tromboplastin | " 0,005 | 70—130 | 60 Nei | ? |
| XII | Faktor Hageman, kontaktfaktor | Til 0,03 | 70—150 | 2- 3 dager | mindre 1 % |
| XIII | Fibrinstabiliserende faktor (fibrinase) | 0,01-0,02 | 70—130 | 2- 3 dager | 2-5% |
| Plasma prekallikrein, Fletcher faktor | Til 0,05 | 60—150 | ? | mindre 1 % | |
| Kininogen med høy molekylvekt (VMC), faktor i Fitzgerald, Flojack faktor, Williams faktor | Til 0,06 | 80—130 | ? | mindre 1 % | |
For å indikere det, at disse faktorene ble aktivert til, bokstaven "a" legges til de numeriske faktorsymbolene, og i så fall; hvis et av fragmentene blir faktorens aktive prinsipp,- bokstaven "f"
I tillegg til den digitale betegnelsen brukes andre navn på koagulasjonsfaktorer - etter deres funksjon (f.eks, faktor VIII - antihemofilt globulin), etter etternavn på pasienter for første gang: oppdaget mangel på en eller annen faktor (faktor XII - Hageman faktor, faktor X - Stewart-Prower faktor og videre), sjeldnere - etter navnene på forfatterne (f.eks, von Willebrand faktor).
Blodpropp motvirkes primære (uavhengig syntetisert) og sekundær, dannet under koagulasjon og fibrinolyse fysiologiske antikoagulantia.
Transformasjon av fibrinogen til fibrin
Det er tilrådelig å begynne å vurdere blodkoagulasjonsprosessen fra det siste stadiet, bestående av, hva er et proteolytisk enzym trombin, dannet fra sin inaktive forgjenger - protrombin, spalter fire peptider fra fibrinogenmolekylet (to A-peptider og to B-peptider), som et resultat av at det dannes fibrinmonomerer, som hver har fire frie bindinger. Ved å koble monomerer med disse bindingene til hverandre, først i par - til dimerer, og deretter til polymerer (ende-til-ende og side-til-side forbindelser). fibrinfibre dannes.
Fibrinogen er et kuleformet glykoprotein (Molekulær vekt 340000), som består av to identiske underenheter. Hver underenhet består av tre kjeder - Aα, Bb og c.
Først spalter trombin peptid A fra dette molekylet (danner des-A-monomerer av fibrin), deretter - peptider B (des-AB eller komplette fibrinmonomerer). Utseende av frie A-peptider i sirkulerende blod (bestemt immunologisk ved bruk av anti-A-serum) fungerer som et tegn på trombinemi og brukes som et "vitne" til intravaskulær koagulasjon (med DVS-sindrome, massiv trombose).
Fibrinmonomerer har en trinolær struktur, og deres kombinasjon til en polymer går gjennom stadiene av dimerdannelse, hvorfra protofibriller dannes når de er koblet på langs og på tvers, og deretter fibrinfibre. Dette fibrinet er løselig i 5-7 M . urea eller inn 2 % monokloreddiksyre, derfor er det betegnet som fibrin S (løselig). Under påvirkning av faktor XIII, som også aktiveres av trombin i nærvær av kalsiumioner, i fibrin dannes det ytterligere disulfidbindinger både mellom γ-, og a-kjeder, hva gjør det. uløselig i urea - fibrin I (uløselig).
Under normale forhold allerede relativt moderate trombinkonsentrasjoner (f.eks, forårsaker blodplasmakoagulering i løpet av 10-12 s) sikre fullstendig transformasjon av fibrinogen til fibrin, på grunn av hvilket dette proteinet ikke lenger påvises i blodserum ved immunologiske og andre metoder.
I motsetning til dette, under prosesser, preget av intravaskulær koagulasjon, følsomheten for trombin reduseres og prosessen med polymerisering av fibrinmonomerer blir forstyrret i en eller annen grad, på grunn av dette forlenges trombin-koagulasjonstiden og de ovennevnte terskeldosene av trombin ikke lenger koagulerer alt fibrinogen. Dette bruddet skyldes det faktum, at noen komplette og ufullstendige fibrinmonomerer danner komplekse forbindelser med fibrinogen og, sannsynligvis, med tidlige produkter av fibrin og fibrinogennedbrytning av plasmin. Disse store molekylære og middels molekylvekt løselige fibrin-monomerkomplekser (SFMC), referert til i litteraturen som "dårlig koagulerende fibrin", "blokkert fibrinogen", koagulerer ikke godt under påvirkning av trombin (har relativ trombinresistens), men danner en gel når den tilsettes til plasma 50 % etanol (etanol test), noen prøver av protaminsulfat, β-naftolløsning i 50 % alkohol, sur ortofenantrolin.
Fenomenet ikke-enzymatisk koagulering av RFMK (blokkert fibrinogen) kalles parakoagulasjonsfenomen og er mye brukt i laboratoriediagnostikk av trombinemi og intravaskulær koagulasjon. Følgende tester lar oss mest mulig identifisere disse kompleksene::
- koagulasjonstest med giften til den sentralasiatiske slangen efa;
- test med ortofenantrolin;
- Test vedheft av stafylokokker.
Dermed, transformasjon av fibrinogen til fibrin kan fortsette som vanlig, og med dannelsen av RFMK (parakoagulasjonsprodukter), identifikasjon av hvilke som er viktige for diagnostisering av intravaskulær koagulasjon.
Generell vurdering av sluttfasen av koagulasjonsprosessen utført ved hjelp av en trombintest, t. Det er. ved å bestemme koagulasjonstiden for sitrert plasma når en standard mengde trombin tilsettes. Testen er av stor betydning for diagnostisering av mange blødningsforstyrrelser, resultatene er viktige for riktig tolkning av avlesningene fra alle andre koagulasjonstester, fordi hemming av sluttfasen av prosessen forlenger koagulasjonstiden i alle andre studier.
Mekanismer for transformasjon av protrombin til trombin
I følge den moderne kaskadekomplekse teorien om blodkoagulasjon, protrombinaktivering (faktor II) er resultatet av en flertrinns enzymatisk prosess, der ulike koagulasjonsfaktorer aktiveres sekvensielt og interagerer med hverandre. Av disse er faktorer III, VII, X, IX, XII og XI, og prekallikrein er proteolytiske enzymer, og faktorene VIII, V - ikke-enzymatiske akseleratorer av prosessen, akselerere aktiveringen av enzymfaktorer mange tusen ganger.
Det er to hovedmekanismer for å utløse koagulasjonsprosessen - ekstern og intern.
Ekstern koagulasjonsmekanisme
Ekstern koagulasjonsmekanisme utløst av vevstromboplastin, som kan komme inn i blodplasmaet fra skadet (skader, operasjoner osv.) vev, karvegger (produsert av skadet endotel med deltakelse av aktiverte blodplater), og kommer også inn i blodet med vevsvæske (fostervannemboli, peritoneal-venøs bypass, forskjellige typer sjokk). Vevstromboplastin kan produseres direkte i blodet av aktiverte monocytter (under påvirkning av endotoksin, immunkomplekser og t. d.).
Vevstromboplastin produseres også i store mengder av cellene til noen ondartede svulster. (inkludert leukemi).
Det aktive prinsippet i vevstromboplastin er proteinet - apoprotein C, mens fosfolipiddelen av faktor III er uspesifikk og fungerer som en matrise som aktiverer prosessen (t. Det er. funksjonelt lik faktoren 3 Blodplate, kefalin, erytrofosfatid).
Fra blodkoagulasjonsdiagrammet kan det sees, at vevstromboplastin danner et kompleks med kalsiumioner og faktor VII, aktiverer den siste, som resulterer i dannelsen av en kraftig enzymaktivator av faktor X.
Under laboratorieforhold simuleres den eksterne mekanismen ved hjelp av protrombintidstesten, hvor vev tilsettes det rekkalsifiserte sitrerte plasmaet fra utsiden (oftest fra menneske- eller kaninhjerne) tromboplastin av en viss aktivitet og koaguleringstid registreres.
Intern koagulasjonsmekanisme
Den interne mekanismen er mye mer kompleks og viktig for å dechiffrere patogenesen og diagnosen av den vanligste hemorragiske diatesen i klinisk praksis - hemofili A og B, angiohemofili, eller von Willebrands sykdom (de står for mer 97 % alle arvelige hemorragiske koagulopatier).
Med en intern mekanisme, blodpropp (plasma) implementert uten deltakelse av vevstromboplastin.
Den utløsende faktoren for denne mekanismen er faktor XII (Hagemana), aktivering som skjer på grunn av kontakt med blod eller med en fremmed overflate (glass, metall, kaolin osv.. d.), eller med subendotel (kollagen) og andre komponenter i bindevev, hva som observeres når veggene i blodårene er skadet (mekaniske skader, vaskulitt, åreforkalkning, etc.. d.).
Foruten, faktor XII kan aktiveres av dens enzymatiske spaltning (kallikrein, plasmin eller andre proteaser). Derav, to typer faktor XII-aktivering er mulig:
- og) kontakt - med dannelsen av faktor XIIa;
- til) enzymatisk - med dannelse av et aktivt fragment av faktor XII (XIII).
Det er visse kvalitative forskjeller mellom effektene av faktorene XIIa (har større effekt på koagulasjonen) og XIII (har en større aktiverende effekt på kallikrein-kinin-systemet og fibrinolyse). Generelt er faktor XII en universell aktivator for alle plasmaproteolytiske systemer - koagulasjon, kallikrein kinin, fibrinolytiske og komplementsystemer.
I innledningen (kontakt) fase av koagulasjonsprosessen oppstår, en side, gjensidig aktivering av faktor XIIa og kallikrein i den komplekse faktor XII - prekallikrein - kininogen med høy molekylvekt, og deretter - aktivering av faktor XI i komplekset av faktorer XIIa - XI - ICH.
Denne innledende fasen er den lengste (4/5 all koagulasjonstid), aktivert med økende areal og varighet av blodkontakt med en fremmed overflate (minimal aktivering ved silikonisering av retter og raskere forskning etter å ha tatt blod fra en blodåre, maksimum - med tillegg av kaolin). Viktig å vurdere, at kontaktaktivering av faktor XII og XI skjer i blod og plasma stabilisert med sitrat eller oksalat, t. Det er. krever ikke kalsiumioner. Deltakelsen av kalsium i blodkoagulasjonen begynner bare fra øyeblikket av aktivering av faktor IX, t. Det er. dannelse av neste kompleks 2.
Når du skaper maksimal kontakt med kaolin og en tilstrekkelig mengde faktor 3 blodplater eller cefalin (t. Det er. i den aktiverte partielle tromboplastintesten) redusert aktivering av faktor XI og langsommere koagulering kan være forårsaket av faktor XII-mangel, XI. prekallikreina, høy molekylvekt kininogen (VMC). Faktor XI-mangel er den vanligste, andre lidelser observeres ekstremt sjelden.
Mye oftere er et brudd på den interne koagulasjonsmekanismen assosiert med en defekt i neste stadium - aktivering av faktorene IX og VIII. Vanligvis, dette skyldes mangel på faktor VIII-komponenter, t. Det er. med hemofili A og angiohemofili eller von Willebrands sykdom (omtrent 93 % alle pasienter), sjeldnere - med faktor IX-mangel (hemofili B).
Den store kliniske betydningen av faktor VIII krever en mer detaljert vurdering av data om dens struktur og funksjon..
I følge moderne data, faktor VIII er en proteinpolymer, bestående av et antall identiske underenheter. Hver underenhet inneholder følgende komponenter:
1) koagulasjonsdel (VIII: FRA) og dets antigen (VIII: SAg);
2) von Willebrand faktor (FV) eller ristomycin blodplateaggregeringskofaktor (VIII: FV, VIII: Pnok) og dets antigen (VIII: Fille, VIII: RAg / FV);
3) karbohydrat del og, kanskje, en annen uidentifisert proteinkomponent.
Syntesested VIII:FRA ikke akkurat etablert, denne syntesen styres av genet, lokalisert på X-kromosomet; dens isolerte brudd er karakteristisk for hemofili A.
Syntese av von Willebrand-faktor (FV) kontrollert autosomalt og forekommer nesten utelukkende i endotelet, Som et resultat brukes denne faktoren som en markør for endotel; nivået i blodet øker kraftig ved mange vaskulære sykdommer.
Mangel på von Willebrand-faktor eller en endring i dens multimere struktur forårsaker brudd på vaskulær blodplatehemostase (langvarig blødning, nedsatt blodplateadhesjon til glass og kollagen eller ristomycin blodplateaggregering), og en reduksjon i koagulasjonsaktivitet VIII:FRA. Disse lidelsene i forskjellige kombinasjoner er observert i ulike typer angiohemofili. VWF finnes i blodet som i plasma, og i blodplater (i a-granulat), Inne i disse cellene er det dessuten separert fra VIII:FRA. For hemofili A nivå VIII:C kraftig redusert, mens plasmainnhold VIII:EF forblir normalt.
Faktor VIII:FRA - ikke-enzymatisk akselerator av faktor IXa, med hvilket det danner et kompleks på fosfolipidmatrisen. VIII er aktivert:Med tilbakemeldingsprinsipp for små doser trombin (IIa) og, kanskje, faktor Xa; samtidig dissosierer den med PV. Etter aktivering spalter og inaktiverer trombin faktor VIII:Med hvor rett, og indirekte ved å aktivere protein C.
Interaksjon mellom de ytre og indre blodkoagulasjonsmekanismene
I kroppen er de eksterne og interne mekanismene for aktivering av blodkoagulasjonssystemet ikke atskilt, og samhandle intimt med hverandre. Så, faktor XII + kallikrein aktivere faktor VII. Gjensidig aktivering av faktorene VIIa og IXa spiller også en betydelig rolle, samt VIIa og Xa.
Faktor VIIa aktiveres også delvis av plasmalipoproteiner og triglyserider, og retrograd med trombin. På grunn av dette fungerer påvisningen av aktivering og økning i nivået av faktor VIIa som en global markør for intravaskulær aktivering av blodkoagulasjonssystemet og høy trombogen risiko, spesielt med koronar hjertesykdom og hyperlipidemi.
Som med eksternt, og med interne koagulasjonsmekanismer interaksjon og aktivering av faktorer utføres på fosfolipidmikromembraner, fungerer som matriser, som de er festet på (ved bruk av kalsiumioner), endre deres kvartære og tertiære struktur, proteinfaktorer reagerer intenst med hverandre. Rollen til slike matriser utføres av membranene til blodplatemembraner og granuler (faktor 3 Blodplate) og lignende komponenter fra membranene til andre celler (erytrocytter, etc.). I stor grad bestemmer tilstedeværelsen av disse fosfolipidmembranmatrisene, at, alt annet likt, plasmakoagulasjonsperioden, inneholder et lite antall blodplater, lengre, enn koagulasjonstiden for plasma med et normalt antall blodplater, og deretter, hva gemoliz (frigjøring av røde blodlegemer) akselererer koagulasjonen kraftig og forvrenger avlesningene fra koagulasjonstester (gjør hemolysert blod uegnet for å studere blodkoagulasjonssystemet).
På grunn av de forskjellige forholdene for fosfolipidaktivering, er avlesningene av ikke-standardiserte koagulasjonstester utsatt for svært store tilfeldige svingninger. Denne spredningen øker enda mer på grunn av ulik intensitet (egenskaper til reagensglass) og varighet av kontaktaktivering av faktor XII. Standardisering av koagulasjonstester ved kontakt (innhenting og behandling av blod under forhold med silikonisering av laboratorieglassvarer eller i fluoroplastiske rør med påfølgende maksimal aktivering av kontaktfasen med kaolin) og ved fosfolipidaktivering (tilsetning av standard mengder cefalin) gjør dem mye mer nøyaktige og reproduserbare.
Til vurdering av blodplatekoagulasjonsaktivitet Kaolin-koaguleringstid for plasma med høyt og lavt blodplateinnhold bør sammenlignes (ekskluderer cefalin fra reaksjonen).
Dermed, en fullstendig vurdering av koagulasjonsprosessen når den starter i henhold til den indre mekanismen utføres ved å studere den totale blodkoagulasjonstiden ved å bruke standardiserte tester - kaolin og kaolin-kefalin (aktivert delvis tromboplastintid), samt en to-trinns autokoagulasjonstest.
En annen ikke-enzymatisk akselerator for koagulasjon aktiveres og inaktiveres på lignende måte - faktor V, interagerer med faktor X. Dette komplekset kalles protrombinase i litteraturen. (i henhold til utdatert terminologi - blodtromboplastin), hvor den aktive enzymdelen er faktor Xa, transformerer protrombin til trombin. På fosfolipidmatrisen (f.eks, på blodplatemembraner) aktiviteten til dette komplekset i 1000 ganger høyere, enn i fravær av fosfolipid. Va-Xa-komplekset i 3000 ganger mer aktiv, enn faktor Xa. Dermed, faktor Va og fosfolipidmatrisen øker sammen protrombinaseaktivitet sammenlignet med isolert faktor Xa i 300000 tid.
På overflaten av hver blodplate er det ca 3000 av fosfolipidreseptorer til Va-Xa-komplekset, hvorav ca 1000 reseptorer med høy affinitet. Fosfolipidmikromembraner av cefalin- og erytrocyttmembraner kan tjene som matriser for alle komplekser av koagulasjonsfaktorer (erytrocytt, erytrofosfatid), som er mye brukt i laboratoriepraksis.
Når det aktiveres av faktor Xa, omdannes protrombin til aktivt α-trombin. I dette tilfellet splittes et fragment sekvensielt fra det 1 og forblir pretrombin 1, og deretter et fragment 2 og forblir pretrombin 2. Med denne spaltningen blir det enkeltkjedede protrombinmolekylet transformert til et dobbeltkjedet. (spaltene A og B) α-trombin molekyl. Da gjennomgår sistnevnte autolyse og mister aktivitet, og inaktiveres også av fysiologiske antitrombiner.
Under påvirkning av andre endos- og eksogene (slangegift osv.) proteolytiske enzymer kan danne en form for trombin, forskjellig fra α-trombin i svakere koagulantaktivitet, mindre følsomhet for heparin-antitrombin III-komplekset og andre egenskaper.
Ionisert kalsium er nødvendig for blodpropp, siden den er involvert i følgende prosesser:
- molekylær konformasjon av koagulasjonsfaktorer til den aktive formen;
- fiksering av interagerende faktorer på fosfolipidmatriser;
- akselerere aktiveringen av individuelle faktorer ved å bli med dem (f.eks, transformasjonen av protrombin til trombin akselererer Ca++ inn 1000 ganger ved å feste den til y-karboksyglutamylrester i NH2-terminal del av molekylet).
Når du analyserer resultatene av grunnleggende koagulasjonstester, er det viktig å vurdere følgende::
- i testsystemene som brukes, er faktor VII bare involvert i prosessens ytre mekanisme, på grunn av hvilket, når det er en mangel på det, bare ca- trombintid;
- faktor XII, XI, IX, VIII og prekallikrein er involvert i den iboende aktiveringsmekanismen, derfor, når de er mangelfulle, blir APTT og ACT forstyrret, mens protrombintiden forblir normal;
- med mangel på faktor X, V, II og I, hvor begge koagulasjonsmekanismene er lukket, patologi oppdages i alle de ovennevnte testene.
Imidlertid er eksterne og interne aktiveringsmekanismer ikke isolert fra hverandre, samhandle med hverandre.
Så, gjensidig aktivering av faktor VII og faktor IX og X ble avslørt, samt aktivering av faktor VII av XIIa–kallikrein–VMC-komplekset. Inkluderingen av disse "broene" mellom interne og eksterne mekanismer fungerer som et av de diagnostiske kriteriene for en pretrombotisk tilstand eller latent intravaskulær koagulasjon. Dette avsløres ved en økning i aktiviteten til faktor VII i blodplasmaet når den testes på plasma, uten denne faktoren, og også bruk av protrombintid kald aktiveringstest med bovint tromboplastin.
Mange koagulasjons- og fibrinolytiske faktorer syntetiseres i leveren. Av disse er faktorer II, VII, X og IX, samt antikoagulanter - proteiner C og SK- vitaminavhengig: det siste stadiet av deres syntese (karboksylering) svekket av fyllokinonmangel (Vitamin K) og under påvirkning av dens antagonister - kumariner, fenylen etc. I dette tilfellet blir dannelsen av K-vitaminavhengig karboksylase i hepatocytter forstyrret, som fratar koagulasjonsfaktorer evnen til å aktivere. Arvelig hemorragisk diatese er beskrevet, der, på grunn av forstyrrelse av syntesen av denne karboksylasen, reduseres nivået av alle K-vitaminavhengige koagulasjonsfaktorer.
I motsetning til dette, Faktor V og en rekke komponenter i de fibrinolytiske og kallikrein-kinin-systemene syntetiseres i leveren uavhengig av fyllokinoner.
