De studie van bloedcoagulatie
Werkwijzen voor het bestuderen bloedstolling systeem zijn de volgende groepen:
- Indicatief (algemeen), geven een beeld van de toestand van het gehele stollingscascade als geheel en de individuele fasen (registratie kan visueel of door afzonderlijke apparaten worden gedaan - koagulografa, tromboelastografie en anderen.);
- differentiëren tekort van individuele factoren - corrigerende stollingstesten, Tests mengen studie bloedplasma bloedplasma van patiënten met een bekende andere deficiëntie van bepaalde factoren;
- kwantificering van de afzonderlijke componenten op hun functionele activiteit (stollingstesten, studies en andere chromogene substraten) en (of) op immunologische markers;
- identificatie van intravasculaire activering van bloedstolling en fibrinolyse van toepasbare moleculaire merkers activeren - identificeren circulerende geactiveerde stollingsfactoren, Product bloedplaatjes degranulatie, splitsing van de componenten van bloedcoagulatie of metabolieten, opkomst van nieuwe antigene marker geactiveerd factoren en hun complexen, versnelde metabolization gelabelde componenten van de bloedstolling (vermindering van de duur van hun halfwaardetijd in de circulatie).
Dus, Bij de beoordeling van bloedstolling correct worden gebruikt coagulatieprocedures (laboratorium en instrumentale), die de basis van het diagnostisch proces, en immunologische, radionuclide en andere vormen van onderzoek. In veel gevallen kunnen de componenten van het systeem gedefinieerd als een functionele activiteit, en immunologisch - de inhoud van het overeenkomstige antigeen in het bloed. Gelijktijdig gebruik van deze technieken kunnen we vormen van pathologie differentiëren, in verband met het gebrek aan synthese van de respectieve stollingsfactor (in dit geval hetzelfde als het wordt neergelaten functionele activiteit, en de hoeveelheid antigen), en schimmel, waarbij het molecuul wordt gesynthetiseerd factor, maar het is abnormaal en functioneel defect.
Om te verwijzen naar het nummer van de eerste vormen van de overeenkomstige factor is de toegevoegde sign "-" (bv, VIII-, IX- en t. d.), en in de tweede - "+" teken (bv, VIII +, IX +).
Ориентировочные (algemeen) stollingstesten
Определение времени свертывания крови
Определение времени свертывания крови (предпочтительнее методике Ли—Уайта) — давно применяющийся быстровыполнимый (непосредственно у постели больного) ориентировочный тест, позволяющий выявлять значительные нарушения свертываемости крови, связанные с дефицитом факторов гемокоагуляции (кроме фактора VII) of het effect van anticoagulantia en fibrinolytische. Het wordt gebruikt als leidraad voor de test en controle over heparine, eliminatie van heparine protamine sulfaat. Тест сравнительно низкочувствительный, показатели его нарушаются лишь при выраженном снижении содержания в плазме факторов свертывания (ниже 4—5 %), en daarom ongeschikt voor het detecteren van lichte vormen van hemofilie A en B, evenals bloeden stoornissen bij angiohemophilia, Factor XI-deficiëntie, прекалликреина и высокомолекулярного кининогена. По этим причинам тест не может использоваться для предоперационного обследования больных: при нормальных показателях теста (5—10 мин) возможно возникновение профузных послеоперационных кровотечений.
Время рекальцификации плазмы
Время рекальцификации плазмы — нестандартизированный низкочувствительный тест, minder betrouwbaar voor de detectie van antistolling, dan stollingstijd voor volbloed. Het kan niet worden aanbevolen voor de diagnose van aandoeningen van hemostase.
Активированное парциальное тромбопластиновое время плазмы
Активированное парциальное тромбопластиновое время плазмы (АПТВ, каолин-кефалиновый тест) — высокочувствительный метод, выявляющий нарушения свертываемости крови при запуске процесса по внутреннему механизму. Избирательно чувствителен к дефициту плазменных факторов свертывания (vanwege het tekort aan bloedplaatjes en factoren 3 Bloedplaatjes gecomprimeerde bestand extern of Kefalonia eritrofosfatidom toegediend).
Het wordt gebruikt om heparine te controleren, предоперационного обследования больных и т. d. Нормативные показатели зависят от используемых образцов кефалина, в большинстве случаев составляют 37—50 с (оптимально — 37—45 с).
Kaolien plasma tijd
Kaolien plasma tijd --test, vergelijkbaar met de vorige, maar zonder dat daardoor het plasma kephaline (eritrofosfatida), zodat deze gevoelig is niet alleen tekort aan plasma stollingsfactoren, maar ook het gebrek aan bloedplaatjes en factor 3 Bloedplaatjes. Geschatte evaluatie activiteit van deze factor kan worden uitgevoerd door vergelijking van het tijdstip kaolien plasma onderzocht met een hoog en laag gehalte aan bloedplaatjes (norm - 57-70 met).
We raden het gebruik van fosfolipide componenten raden, toegeven aPTT stollingstijden gelijk 55 s en nog veel meer, aangezien drastisch vermindert de nauwkeurigheid en reproduceerbaarheid van de test, waaronder de kwantitatieve bepaling van Factoren VIII en IX.
Silicone plasma tijd
Siliconen plasma tijd - een tijd van plasma recalcificeringstijd, verkregen onder de omstandigheden van de naald silikonirovaniya, tubes, pipetok, t. het is. met een minimum contactactivatiefactoren. De test is gevoelig voor de hypercoagulabele stand van intravasculaire activatie van de contactfase van het opstarten (factoren XII, XI), однако это нарушение более четко выявляется путем определения силиконового времени свертывания цельной крови (на основе метода Ли—Уайта либо тромбоэластографической регистрации процесса в силиконированной кювете).
Standaardindicatoren afhankelijk van de siliconen en wordt bepaald door het onderzoeken van het bloed van gezonde mensen voor elk monster afzonderlijk. Bij de keuze van silicone is de beste, который в наибольшей степени удлиняет время свертывания крови (plasma).
Протромбиновое (тромбопластиновое) время плазмы
Протромбиновое (тромбопластиновое) время плазмы (время Квика, protrombine index) характеризует скорость свертывания рекальцифицированной плазмы крови при запуске процесса по внешнему механизму, t. het is. при добавлении тромбопластина мозга человека (или кролика).
activiteit tromboplastine gestandaardiseerd gemengde normale monsters (test) plasma. De meest gebruikte tromboplastine-activiteit met 12-18 (in klassieke techniek met Kvika- 12-13). Чем слабее тромбопластин, тем больше ошибка метода.
In normale protrombinetijd plasma test toont geïsoleerde of gecombineerde tekort aan factoren van het protrombinecomplex - VII, X, V en II, waarvan de drie factoren (VII, X и II) К-витаминозависимы и их активность снижается под влиянием антикоагулянтов непрямого действия. В связи с этим протромбиновый тест является основным при контроле за дозировкой кумаринов (neodikumarin, of pelentan, sinkumar et al.) en andere drugs in deze groep (fenilin).
Протромбиновое время остается нормальным при дефиците факторов внутреннего механизма активации протромбиназы — факторов XII, Xi, IX, Viii (t. het is. при всех видах гемофилии и дефекте Хагемана), а также при дефиците прекалликреина и высокомолекулярного кининогена (ВМ кининогена)
В литературе принято разное обозначение результатов протромбинового теста. Наиболее целесообразно указывать протромбиновое время исследуемой и контрольной плазмы крови в секундах (что дает информацию и об активности использованного тромбопластина). Иногда пользуются соотношением этих двух величин, t. het is. индексом (ПВ исследуемой плазмы, van ,)/(ПВ контрольной плазмы, van), (норма 0,9—1,1).
Другой формой оценки этого показателя, которой наиболее широко пользуются в лабораториях, является вычисление протромбинового индекса в процентах путем составления обратной арифметической пропорции (норма — 90—110%), однако такой расчет является неправильным, так как между концентрацией факторов свертывания и временем свертывания имеется не арифметическая, а логарифмическая зависимость. Behalve, протромбиновый тест чувствителен лишь к снижению факторов свертывания ниже 50 % их нормальной величины. В силу этого целесообразно использование определения протромбинового индекса в процентах по кривой разведения (1:2, 1:4, 1:8 en t. d.) смешанного образца нормальной плазмы. Такая кривая строится однократно для тромбопластинов разной исходной активности (van 12 naar 18 van) и по ней определяется протромбиновый индекс у исследуемых больных. Преимущество такой методики состоит также в том, что результаты всех исследований, в том числе и выполняемых в динамике в разные дни, соотносятся не к случайным различным образцам нормальной плазмы крови, а к усредненным одним и тем же стандартным параметрам, вследствие чего существенно уменьшается ошибка метода. Индексы, полученные по пропорции и по кривой разведения нормальной плазмы, совершенно не соответствуют друг другу. Это следует учитывать и при контроле за действием непрямых антикоагулянтов, ибо снижение обычного индекса до 50 % примерно соответствует снижению индекса по кривой разведения до 25—30 %• В связи с этим в анализах всегда следует указывать, как рассчитывался протромбиновый индекс, каковы его нормативные показатели для тромбопластина данной активности.
Тромбиновое время плазмы
Тромбиновое время плазмы, t. het is. время свертывания цитратной плазмы при добавлении к ней тромбина стандартной активности, является основным тестом для оценки конечного этапа свертывания крови. Учет этого показателя важен для правильного толкования всех остальных коагуляционных тестов, ибо нарушение конечного этапа свертывания крови неизбежно должно привести к удлинению времени свертывания во всех перечисленных выше методиках.
В большинстве случаев при проведении тромбинового теста используется такая концентрация раствора тромбина, которая при смешивании с равным объемом плазмы крови дает свертывание за 12— 18 van, но при распознавании дисфибриногенемий используются и более слабые его концентрации (приводящие к свертыванию за 30—35 с).
Тромбиновое время — важный диагностический показатель, нарушение его наблюдается как при врожденных, так и при часто встречающихся приобретенных (secundair) гипопротромбинемиях, при большинстве дисфибриногенемий, а также под влиянием гепарина, продуктов фибринолиза (ПДФ) и ряда других антитромбинов и ингибиторов самосборки мономеров фибрина. В силу этого тромбиновое время в первую очередь и в большей степени нарушается при острых и подострых ДВС-синдромах, что играет важную роль для экспресс-диагностики этой патологии.
Аутокоагуляционный тест
Аутокоагуляционный тест (АКТ) — высокочувствительный двухступенчатый, характеризует процесс свертывания крови при запуске его по внутреннему механизму. Как и АПТВ, тест не чувствителен к дефициту фактора VII, но вместе с тем его показания не зависят от содержания фибриногена (фактора I) в исследуемой плазме крови, чем он отличается от всех остальных ориентировочных коагуляционных проб.
Другое достоинство АКТ состоит в том, что исследуется разведенная кровь, благодаря чему существенно повышается чувствительность теста к дефициту факторов свертывания и, Behalve, выполнение АКТ не требует использования каолина и кефалина, поскольку стандартизация контактной и фосфолипидной активации в нем достигается гемолизатом собственных эритроцитов исследуемого.
Сущность АКТ состоит в том, что к 2 мл гипотонического раствора (0,222 %) хлорида кальция добавляется 0,1 мл крови исследуемого.
В этой гемолизат-кальциевой смеси происходит образование протромбиназы и тромбина, активность которых определяется последовательным добавлением 0,2 мл этой смеси к 0,2 мл плазмы исследуемого (ieder 2 мин на протяжении первых 10 m, а затем — через каждые 10 min gedurende 1 Nee).
Плазма исследуемого является источником фибриногена, на котором тестируется активность образующегося в смеси тромбина. Как показали многочисленные исследования, она может быть заменена плазмой крови здоровых людей или раствором фибриногена. В этом случае расход крови больного сокращается до 0.1—0,2 мл (может быть взята из пальца!), wat трансформирует аутокоагуляционный тест в микрокоагуляционный (МКТ) и делает его очень удобным для использования в педиатрии, в том числе при исследовании гемостаза у новорожденных.
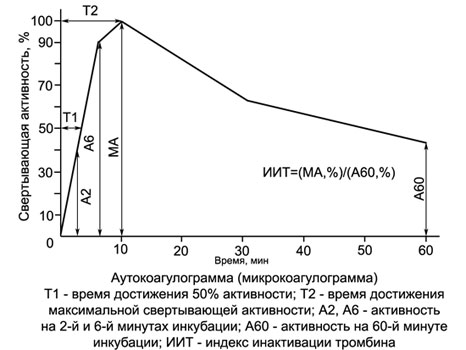
Коагуляционная активность в АКТ и МКТ вначале нарастает и у здоровых людей обычно достигает максимума к 10-й минуте, инкубация кровь-кальциевой смеси (ККС), когда свертывание субстратной плазмы происходит за 10±1 с. Затем коагуляционная активность ККС начинает снижаться, что свидетельствует об инактивации образовавшегося в ней тромбина. При гемофилиях, действии гепарина и других нарушениях свертываемости коагулирующая активность ККС резко снижается, а максимум перемещается с 10-й минуты на более поздний срок. При гиперкоагуляции наблюдается более раннее и более значительное нарастание тромбиновой активности в ККС.
При проведении теста в одной пробирке (определение только на 10-й минуте инкубации ККС) он может быть использован для контроля за гепаринотерапией. Преимущество этой методики перед тестом активированного парциального тромбопластинового времени состоит в том, что в ней нивелируется неодинаковое влияние разных кефалинов на гепариновое время свертывания.
На основе АКТ (МКТ) разработана простая и точная методика дифференциальной диагностики гемофилий.
С помощью приводимых в справочниках переводных таблиц показания АКТ (МКТ) могут быть выражены в процентах и изображены в виде графика — аутокоагулограммы.
Для оценки ряда общих параметров свертываемости крови широко используются и инструментальные методы исследования, преимущественно с применением различных коагулографов и тромбоэластографов.
Тромбоэластография дает представление не только о временных параметрах свертывания крови или плазмы, но и о структуре и механических свойствах образующихся сгустков. В последние годы и в аппаратные методы регистрации вводится стандартизация контактной и фосфолипидной активации процесса свертывания. Создаются также коагулограммы для массового выполнения общих коагуляционных тестов — АПТВ, протромбинового, тромбинового и других с автоматической записью результатов.
Методы дифференциации дефицита различных факторов свертывания и их количественного определения
Приведенные ниже в таблице данные показывают, что ориентировочное исследование свертываемости крови с помощью трех основных тестов позволяет провести групповое разграничение дефицита различных плазменных факторов гемокоагуляции. Dus, замедление свертываемости только в протромбиновом тесте (I тип нарушения) при нормальных показаниях всех остальных характерно для наследственного дефицита фактора VII либо для снижения уровня этого фактора на ранних этапах развития механической желтухи или в первые 1—2 дня лечения антикоагулянтами непрямого действия, когда подавление синтеза фактора VII опережает в своем развитии снижение уровня всех остальных К-витаминозависимых факторов свертывания.
Типы нарушений основных коагуляционных тестов при дефиците тех или иных плазменных факторов свертывания | ||||
Тип нарушений | Дефицитные факторы в исследуемой плазме крови | Коагуляционные тесты | ||
АПТВ, АКТ | ПВ | ТВ | ||
| Ik | VII | – | + | – |
| IK IK | XII | + | – | – |
| Xi | + | – | – | |
| IX | + | – | – | |
| Viii | + | – | – | |
| Фактор Виллебранда | + | – | – | |
| Плазменный прекалликреин | + | – | – | |
| ВМ кининоген | + | – | – | |
| III | IK IK | + | + | – |
| V | + | + | – | |
| X | + | + | – | |
| VII | – | + | – | |
| IX | + | – | – | |
| Ik | + | + | + | |
| XIII | – | – | – | |
| IV | Антикоагулянты прямого действия (Heparine, гепариноиды и др.) | + | + | + |
| Антикоагулянты непрямого действия (kumarinы) | + | + | – | |
| Aantekening. (+) — замедление свертывания; (-) — отсутствие нарушения свертывания. | ||||
Нарушение только внутреннего механизма свертывания, t. het is. активированного парциального тромбопластинового времени и АКТ (II тип), наблюдается при дефиците факторов XII, Xi, IX, Viii, Виллебранда (niet in alle vormen), прекалликреина и ВМ кининогена. Из них при наследственных дефектах свертываемости дефицит факторов XII, прекалликреина и ВМ кининогена наблюдается крайне редко и не сопровождается какой-либо кровоточивостью, тогда как дефицит факторов VIII (hemofilie A), IX (гемофилия В) и фактора Виллебранда встречается очень часто (составляет более 96 % всех наследственных коагулопатий) и сопровождается выраженной кровоточивостью. Между ними в первую очередь и проводится дальнейшая дифференциальная диагностика.
Дефицит фактора XI встречается сравнительно редко (около 0,5—1,0 % всех гемофилий), протекает с очень слабо выраженной кровоточивостью (в основном после травм и операций) и занимает промежуточное место между первой подгруппой бессимптомных нарушений и гемофилиями и болезнью Виллебранда.
Еще один тип нарушений характеризуется удлинением как парциального тромбопластинового времени и АКТ, так и протромбинового времени. Он характерен для дефицита факторов V, X или II либо для комплексного дефицита всех К-витаминозависимых факторов (VII, X, IX, IK IK), что наблюдается при механической желтухе и других видах К-витаминной недостаточности, а также при приеме антикоагулянтов непрямого действия.
Tenslotte, как видно из той же таблицы, возможно нарушение показаний всех трех тестов (IV тип), что наблюдается при наследственных и приобретенных гипо- en dysfibrinogenemie (не всех), при приеме антикоагулянтов прямого действия (geparina, гепариноидов, гирудина и др.), лечении активаторами фибринолиза и дефибринирующими препаратами (streptokinase, урокиназа и др.), появлении в крови патологических антитромбинов и веществ, препятствующих соединению (сборке) фибрин-мономеров — парапротеинов, криоглобулинов, иммунных комплексов, а также при сложных нарушениях свертываемости, обусловленных ДВС-синдромом. При этом тромбиновое время часто нарушается в большей степени и несколько раньше, чем другие тесты.
При учете давности заболевания и возможности его наследственного генеза либо вторичной связи с другими видами патологии и лекарственными или иными воздействиями, наличия или отсутствия кровоточивости и ее типа удается правильно определить генез этих глубоких нарушений свертывания крови.
Alles дифференцирующие тесты основаны на принципе коррекции, t. het is. на определении, в какой степени выявленное нарушение свертываемости крови устраняется или, omgekeerd, не устраняется образцами плазмы крови или искусственно полученными препаратами крови с заведомо известным дефицитом того или иного фактора свертывания.
С этой целью специализированные лаборатории создают для себя коллекции фактородефицитных плазм крови, получая их от больных с заведомо установленным глубоким (minder 1 %) дефицитом каждого из факторов и хранят их в мелкой расфасовке (door 0,5 ml) при температуре — 30 ° C. При необходимости эти образцы размораживают и используют в диагностических тестах.
Plasma, подвергшаяся случайному размораживанию или оставшаяся неиспользованной, повторному замораживанию не подлежит. В коррекционных тестах не следует использовать плазму с иммунными ингибиторами того или иного фактора. В диагностических наборах ряда фирм содержатся лиофильно высушенные образцы плазмы крови с дефицитом определяемых факторов свертывания (субстратные плазмы). Однако многие нарушения свертываемости крайне редко наблюдаются в клинической практике, в связи с этим используются искусственно приготовленные компоненты нормальной крови с дефицитом тех или иных факторов свертывания, а также гетерогенные плазмы (цыплят, утят и др.).
В таблице приведены сведения о содержании факторов свертывания крови в компонентах крови, используемых для проведения коррекционных коагуляционных тестов в зависимости от сроков их хранения. Пользуясь этой таблицей, легко расшифровать показания любого из трех основных коагуляционных тестов. В коррекционных методиках такого рода используются тесты, стандартизированные по контакту и фосфолипидной активации, t. het is. каолин-кефалиновые или с применением гемолизата (в АКТ).
Содержание факторов свертывания а плазме крови с различными сроками хранения, используемой для проведения коррекционных тестов | ||
Плазма крови | Фактор свертывания | |
внутреннего механизма | внешнего механизма | |
VIII IX XI XII прекалликреин | VII X V IK IK | |
| Нативная (со сроком хранения до 18 Nee) | ++++ | ++++ |
| Адсорбированная * | +-++ | –+- |
| Со сроком хранения более 24 Nee | -+++ | ++– |
| Со сроком хранения 2—4 дня (при температуре +4°С) | Не используется | ++-+ |
| Профильтрованная ** | Не используется | –++ |
| Нативная плазма цыплят или утят (в возрасте до 3—4 дней) | +++- | Не используется |
| Aantekening. (+) — наличие фактора; (-) — отсутствие. | ||
| * Адсорбция производится либо сульфатом бария из оксадаткой плазмы (BaSO4-плазма). либо гелем гидроокиси аллюминня из цитратной плазмы (Al(OH)3-плазма). | ||
| ** Фильтрация производится через два асбестовых фильтра (фильтры Зейца) — с 20 % (верхний фильтр) en 30 % (нижний фильтр) содержанием асбеста либо через удвоенный или утроенный соответственно 30 en 20 % фильтры. | ||
Тесты смешивания плазмы крови больного с плазмой, имеющей заведомо известный дефицит того или иного фактора
Определяют активированное парциальное тромбопластиновое время в исследуемой плазме крови, нормальной плазме (контроль) и в плазме с заведомо известным дефицитом факторов VIII (от больного гемофилией А), IX (от больного гемофилией В), XI и XII. Затем готовят смесь из образцов цитратной плазмы исследуемого (7/10 объема) и последовательно с каждой из дефицитных плазм (3/10 объема), начиная с дефицита фактора VIII и IX (наиболее частые формы патологии!).
К смеси добавляют каолин и кефалин, en 2 мин подвергают ее рекальцификации (bij een temperatuur 37 ° C). В той смеси, где активированное парциальное тромбопластиновое время не нормализуется, имеется один и тот же дефект свертывания.
Dus, если у обследуемого больного активированное парциальное тромбопластиновое время не нормализуется добавлением плазмы крови больного с заведомо известным дефицитом фактора VIII, но корригируется плазмой крови больного с дефицитом фактора IX, у него имеется hemofilie A.
Evenzo, но на основе протромбинового теста дифференцируют дефицит факторов протромбинового комплекса (X, V, VII и II).
Тест генерации тромбопластина
Для дифференциации нарушений внутреннего механизма свертывания крови чаще всего используется классический тест генерации тромбопластина с заменой тромбоцитарного компонента, приготовление которого требует значительной затраты времени и крови, кефалином Недостатками теста генерации тромбопластина являются его громоздкость, необходимость приготовления большого числа реагентов, значительная затрата времени на его выполнение.
Коррекционный тест, основанный на базе аутокоагуляционного теста.
Задачам экспресс-диагностики вполне отвечает другой коррекционный тест, основанный на проведении коррекции теми же компонентами нормальной крови на базе аутокоагуляционного теста.
Этот тест отличается высокой надежностью, быстротой и легкостью выполнения и требует небольшого (niet meer 0,5 ml) количества крови исследуемого, что позволяет использовать его в педиатрической практике.
В нем, как и в тесте генерации тромбопластина, используют для коррекции адсорбированную плазму и старую сыворотку крови, которую повторно центрифугируют перед проведением исследования. В три пробирки разливают по 2 ml 0,222 % раствора хлорида кальция и в две из них добавляют 0,1 мл адсорбированной нормальной плазмы крови (1-я пробирка) en 0,1 мл старой нормальной сыворотки крови (2-я пробирка). В три другие пробирки вносят по 0,2 мл нормальной цитратной плазмы. Затем во все пробирки с раствором хлорида кальция добавляют по 0,1 мл цитратной крови исследуемого.
Ровно через 4 мин инкубации этой смеси ее свертывающую активность тестируют на нормальной плазме.
Резкое снижение коагулирующей активности только в первой пробирке (с нормальной BaSO4-плазмой) свидетельствует о наличии у больного дефицита фактора IX (гемофилия В), только во второй пробирке (со старой сывороткой) — о дефиците фактора VIII (hemofilie A); если коррекция происходит в обеих пробирках (одинаково сильная), dan, blijkbaar, имеется дефицит фактора XI или XII (cm. Tafel. 14).
Коагуляционные тесты, дифференцирующие нарушения свертывания крови по внутреннему механизму (при нормальном протромбиновом и тромбиновом времени) | |||
Дефицитные факторы в исследуемой плазме крови | Компоненты нормальной крови, добавляемые к исследуемой плазме | ||
Адсорбированная плазма (без фактора IX) | Старая сыворотка (без фактора Viii) | Смесь адсорбированной плазмы и старой сыворотки | |
| Фактор VIII | + | – | + |
| Фактор IX | – | + | + |
| Факторы XI или XII | + | + | + |
| Aantekening. (+) — нормализация свертывания; (-) — отсутствие нормализации свертывания. | |||
Данный тест высокочувствителен, так как исследование проводится на разведенной в 20 раз крови при компенсации фактора 3 тромбоцитов гемолизатом. Единственный используемый реактив — гипотонический раствор хлорида кальция, что делает пробу общедоступной.
Столь же простой является методика коррекционных проб, выполняемых на основе протромбинового теста для дифференциации дефицита факторов II, V и VII+, X (in de tafel).
Коагуляционные тесты, дифференцирующие дефицит факторов II, V и VII+, +X, выполняемые на основе протромбинового теста (при нормальном тромбиновом времени) | ||||
Дефицитные факторы в исследуемой плазме крови | Компоненты нормальной крови, добавляемые к исследуемой плазме | |||
Адсорбированная плазма (без факторов II, VII, X) | Старая плазма (без фактора V) | Профильтрованная плазма (без факторов VII и X) | Старая сыворотка (без факторов II и V) | |
| Факторы VII или X | – | + | – | + |
| Фактор V | + | – | + | – |
| Фактор II | – | + | + | – |
| Aantekening. (+) — нормализация свертывания; (-) — отсутствие нормализации свертывания. | ||||
Для того чтобы разграничить дефицит факторов VII и X, выполняется дополнительный коагуляционный тест с добавлением к исследуемой плазме крови раствора яда змеи гюрзы — препарат лебетокс (подбирается такая концентрация яда, которая в присутствии кефалина и хлорида кальция вызывает свертывание за 20—25 с; все ингредиенты берутся в количестве 0,1 мл и смешиваются) (таблица ниже).
С этой же целью используется препарат яда гадюки Расселла, обитающей в Индии (voorbereiding стипвен).
Коагуляционные тесты, дифференцирующие дефицит факторов VII и X с помощью яда гюрзы (лебетокс) | |||
Дефицитные факторы в исследуемой плазме крови | Tests | ||
с ядом гюрзы+кефалин+хлорид кальция | с ядом гюрзы+кефалин+хлорид кальция+профильтрованная плазма крови (источник факторов V а Viii) | протромбиновый | |
| Фактор X | – | – | – |
| Фактор VII | – | + | + |
| Aantekening. (+) — нормализация свертывания; (-) — отсутствие нормализации свертывания. | |||
Дифференциальную диагностику завершают при необходимости количественным определением дефицитных факторов или их специфических иммунных ингибиторов, для чего применяются специальные высокочувствительные стандартизированные методики. В этих методиках используется построение кривых разведения смешанных образцов нормальной плазмы крови с коррекцией дефицита всех факторов, кроме исследуемого. По этим кривым определяется активность исследуемого фактора в плазме больных.
Vooral важно количественное определение концентрации факторов VIII и IX, а также наличия их ингибиторов у больных гемофилией А и В (особенно до и во время хирургических вмешательств и при проведении интенсивной заместительной терапии), а также при отсроченных профузных послеродовых кровотечениях, когда приходится дифференцировать ДВС-синдром и более редкую патологию — появление иммунного ингибитора фактора VIII (еще намного реже — фактора V).
При глубоком дефиците фактора XIII (очень редкая наследственная патология) все коагуляционные пробы нормальны, но сгустки растворяются в 5М или 7М мочевине.
Помогает дифференцировать дефицит различных факторов свертывания также и учет степени и, vooral, сроков нормализации показаний тестов после внутривенного введения больным препаратов крови, t. het is. учет коррекции in vivo по методике Л. 3. Баркагана.
Особенно эффективна эта методика при большой разнице продолжительности жизни дифференцируемых факторов в циркуляции. Dus, продолжительность полужизни факторов протромбинового комплекса варьирует от нескольких часов (factor VII) до нескольких дней (фактор II). Промежуточное положение между ними занимают факторы X (2—2,5 дня) en V (12—18 ч).
Поэтому после массивной струйной трансфузии плазмы протромбиновый индекс повышается при дефиците фактора VII очень кратковременно, при дефиците фактора V — несколько более длительно (примерно в 4—6 раз), а при дефиците факторов X и, vooral, II на более продолжительный срок (свыше 1—2 суток). Показательно в этом отношении и влияние на протромбиновый индекс препарата ППСБ (концентрата факторов VII, IX, X и II). Он также кратковременно нормализует протромбиновое время при дефиците фактора VII и более длительно (во много раз!) при дефиците факторов X и II. Поскольку в этом препарате отсутствует фактор V, данный дефицит им не корригируется.
Аналогичное различие выявляется при трансфузионной и заместительной терапии факторов внутреннего механизма свертывания (XII, Xi, IX и VIII), что регистрируется активированным парциальным тромбопластиновым тестом.
Особый интерес представляет динамика коррекции уровня фактора VIII и показаний АПТВ при трансфузионной терапии гемофилии А и болезни Виллебранда. При первом из этих заболеваний выявляется немедленное максимальное улучшение свертываемости после трансфузии (besproeien, snel!) антигемофильной плазмы или введения криопреципитата, а затем довольно быстрое (за 10—18 ч) неуклонное снижение ее, тогда как при болезни Виллебранда наблюдается некоторое нарастание свертывающей активности в течение нескольких часов после трансфузии, а затем ее снижение — намного более медленное, чем при. В связи с этим при лечении болезни Виллебранда более редко прибегают к заместительным трансфузиям, чем при гемофилии А.
Исследование функциональной активности факторов свертывания и компонентов калликреин-кининовой и фибринолитической систем с помощью хромогенных субстратов
Методы основаны на исследовании активности протеолитических ферментов и их ингибиторов, участвующих в свертывании крови, фибринолизе и образовании кининов, по интенсивности и скорости расщепления специфически чувствительных к этим ферментам пептидов, при деградации которых освобождается красящий агент (β-нитроанилин).
Степень окраски реагирующей смеси определяется спектрофотометрически, и по ее интенсивности судят об активности соответствующих ферментов (факторов свертывания, kallickreina, плазмина и др.), а по торможению процесса — об активности ингибиторов ферментов.
Dus, bv, действие гепарина и антитромбина III может быть оценено по ослаблению расщепления хромогенных субстратов фактором Xa или тромбином, а активность α2-антиплазмина — по ослаблению действия плазмина на соответствующий хромогенный субстрат. Хромогенные субстраты либо имеют цифровое обозначение (bv, s-2222), либо именуются хромозинами с сокращенной приставкой, обозначающей тот фермент, к которому чувствителен этот субстрат (bv, Chromozym PL — субстрат плазмина, Chromozym TH — субстрат тромбина, Chromozym PK — субстрат прекалликреина/калликреина и т. d.).
Хромогенные субстраты расширяют возможности исследования системы гемостаза, но пока недостаточно доступны для многих лабораторий. Некоторые исследования, выполненные с их помощью, не имеют преимуществ перед обычными коагуляционными тестами и дают совпадающие с ними результаты; в других случаях их использование упрощает и ускоряет исследование, делает его более точным; в третьих — эти методики имеют самостоятельное значение и не могут быть заменены коагуляционными тестами (bv, определение прекалликреина).
Иммунологическое определение компонентов системы гемостаза
Иммунологическое определение компонентов системы гемостаза выполняется методами:
- Иммунопреципитации;
- Иммуноэлектрофореза;
- Радиоиммунологическими и другими с соответствующими антисыворотками
При этом оценивается содержание в плазме крови антигена того или иного фактора свертывания (или его фрагментов), а не функциональная активность, которая может быть резко сниженной при нормальном содержании антигена в плазме. Такая ситуация характерна для всех тех случаев, когда в организме синтезируются аномальные (функционально неполноценные) factoren, сохраняющие свою антигенность, но лишенные способности участвовать в гемостазе.
Это позволяет разграничивать полное прекращение синтеза соответствующих факторов и образование их аномальных форм.
Вместе с тем ряд компонентов системы гемостаза может определяться только иммунологически.
В эту группу входят такие важные исследования, как определение следующих компонентов:
- β-тромбоглобулина;
- α2-макроглобулина;
- протеинов C и S;
- антигенов факторов VIII:C и VIII:Rcof;
- продуктов фибринолиза (ПДФ);
- неоантигенов комплексов тромбин — антитромбин III и плазмин — антиплазмин;
- ряд других тестов.
Поэтому иммунологическое исследование существенно дополняет функциональную оценку разных звеньев системы гемостаза.
Diagnostische tests, основанные на использовании в качестве реагентов препаратов из змеиных ядов
Давно установлено, что яды многих змей содержат высокоактивные протеолитические ферменты, вызывающие свертывание крови и воздействующие на разные звенья коагуляционного каскада. Вследствие этого змеиные яды и выделенные из них коагулазы широко используются для распознавания нарушений гемостаза, количественного определения факторов свертывания, выявления и количественного определения растворимых фибрин-мономерных комплексов (РФМК) и ряда других исследований.
Пробы со змеиными ядами часто намного упрощают и делают более оперативной диагностику нарушений гемостаза.
В таблице приведены данные о механизме действия ядов на свертывающую систему крови и возможностях диагностического использования каждого из них.
Гемокоагулирующие свойства змеиных ядов и их использование в диагностической практике | |||
Наименование змей * и препаратов из их ядов | Механизм действия на свертывающую систему | Отличия от свойств естественных факторов свертывания | Возможности диагностического применения |
| Гюрза Vipera lebetina); лебетокс (гадюка Расселла; стипвен) | Активатор фактора X (в присутствии кальция, фактора V и фосфолипида **) | В отличие от тканевого тромбопластина не содержит фосфолипида и не компенсирует его дефицита. Не нуждается для реализации свертывания в факторе VII | Определение фактора и тромбоцитов и его освобождения при агрегации; разграничение дефицита факторов VII и X; количественное определение фактора X |
| Эфа многочешуйчатая (Echis multisgumatos) и эфа песчаная (Echis carinatus); экарин, эхитокс | Активатор фактора II, образует атипичный тромбин-Ем | В отличие от α-тромбина, тромбин-Ем не блокируется гепарином и антитромбином III, не активирует фактора XIII (сгустки лизируются в мочевине), коагулирует весь пул фибриногена и все растворимые комплексы фибрин-мономеров | Выявление гиперкоагуляции, в том числе скрытой, при лечении гепарином; количественное определение всего фибриногена и РФМК с целью диагностики тромбинемии и ДВС- syndroom |
| Щитомордник обыкновенный (Aghistrodon halus halus), а также многие гремучие змеи тропической Америки и Азии; анцистрон-Н1, рептилаза, ботропклотаза, кроталаза, анкрод и др. | Свертывает фибриноген, отщепляя только пептиды А и образуя неполные мономеры фибрина (дес-А-фибрин) | Не отщепляет пептиды В, не активирует фактор XIII и тромбоциты, не вызывает ретракцию сгустков, не блокируется гепарином, быстро лизирует сгустки | Распознавание дисфибриногенемий; оценка роли гепарина в нарушении конечного этапа свертывания (в сопоставлении с тромбиновым временем) |
| * Все указанные змеи обитают в Средней Азии (в скобках указаны другие виды со сходным механизмом действия и фирменные препараты из них; гадюка Расселла обитает в Индии, гадюка Дабойа — в Австралии. | |||
| ** Аналог кефалина и тромбоцитарного фактора 3. | |||
Эти возможности еще более расширяются при одновременном использовании нескольких ядов и простейших общих коагуляционных тестов. Dus, bv, одновременное применение коагуляционных проб с ядом гюрзы и эфы позволяет легко дифференцировать дефицит факторов VII, Х-V и II (в таблице ниже), а с дополнительной коррекцией профильтрованной нормальной плазмой (источник факторов V и II) —дефицит факторов X и V.
Коагуляционные тесты с применением различных ядов, дифференцирующие дефицит факторов протромбинового комплекса | |||
Дефицитные факторы в исследуемой плазме крови | Tests | ||
с ядом гюрзы+кефалином | с ядом эфы | протромбиновый | |
| VII | + | + | – |
| X+V | – | + | – |
| IK IK | – | – | – |
| Aantekening. (+) — нормализация свертывания; (-)—отсутствие нормализации свертывания. | |||
Определение основных физиологических антикоагулянтов
Наиболее важное значение имеет определение активности основного физиологического антикоагулянта — антитромбина III, снижение которой может быть генетически обусловленным (первичная тромбофилия) либо вторичным вследствие интенсивного потребления (DIC, массивные тромбозы) или ускоренного метаболизма (лечение гепарином, L-аспарагиназой, синтетическими контрацептивными средствами) и блокады иммунными комплексами, парапротеинами, фибронектином, белками острой фазы.
В любом случае снижение активности антитромбина III ниже 60—65 % поддерживает внутрисосудистое свертывание крови, делает менее выраженным антикоагулянтное действие гепарина. Вместе с тем очень часто между уровнем антитромбина III и снижением чувствительности к гепарину нет закономерного соответствия.
При этом обычно ослабление антикоагулянтного действия гепарина существенно преобладает над степенью снижения активности антитромбина III. Bewezen, что при разных формах дефицита антитромбина III сродство его к гепарину может меняться в различной степени. Behalve, разные фракции гепарина, соотношение которых в лекарственных средствах весьма изменчиво, также имеют различное сродство к антитромбину III. Поэтому практически важно исследовать как собственно активность антитромбина III, так и его способность превращаться под влиянием гепарина в быстродействующий антикоагулянт.
Антикоагулянтная активность антитромбина III
Антикоагулянтная активность антитромбина III определяется по способности исследуемой плазмы крови (разведенной — метод Копли—Винтерштейна или дефибринированной тепловой денатурацией bij een temperatuur 56 °С — методы Лолигера, Абильдгаарда и др.) инактивировать в течение определенного срока вводимый извне тромбин. Остаточная активность тромбина в такой плазме может определяться по ее свертывающей активности (на фибриногене, адсорбированной сульфатом бария плазме) либо по расщеплению хромогенного субстрата, чувствительного к тромбину или фактору Xa (поскольку антитромбин III инактивирует и этот фактор).
Гепарин-кофакторная активность
Гепарин-кофакторная активность содержащегося в плазме крови антитромбина III длительный период определялась с помощью теста толерантности плазмы к гепарину, который может считаться ориентировочным, поскольку дает очень большой разброс нормальных показателей и недостаточно воспроизводим.
Значительно более точны и воспро изводимы тесты, в которых исследуется влияние различных концентраций гепарина на тромбиновое время исследуемой плазмы, содержащей небольшое количество тромбоцитов. Сравнение проводится с удлинением тромбинового времени контрольной нормальной плазмы крови, к которой добавляются те же образцы гепарина.
Dus, в тромбин-гепариновом тесте к исследуемой плазме крови добавляются такие количества гепарина, которые в контроле удлиняют тромбиновое время с 15 до 32—35 с (малая концентрация) и до 95—110 с (высокая концентрация гепарина). По этим данным рассчитываются индексы активности антитромбинов плазмы (ААП) и антикоагулянтного резерва плазмы (АРП).
Также широко используются сходные методики с оценкой степени инактивации тромбина как в коагуляционных тестах, так и на хромогенных субстратах.
Иммунологическое определение антигена антитромбина III
Иммунологическое определение антигена антитромбина III позволяет дифференцировать различные виды тромбофилии:
- с недостаточным синтезом антитромбина III (уровень антигенного маркера снижен адекватно снижению активности);
- с сохраненным синтезом аномальных и функционально неполноценных его форм (уровень антигенного маркера намного выше, чем активность).
Протеины C и S, тромбомодулин и α2-макроглобулин определяются иммуноэнзиматическими методами.
