Anemia, associato disgregazione della struttura di catene globiniche
Anemia, associato disgregazione della struttura di catene globiniche, emoglobinopatie, o - un gruppo di malattie, a causa della sostituzione di uno o più aminoacidi nella catena globina, l'assenza di catena, o la sua estensione.
Il quadro clinico di emoglobinopatie Essa dipende dalla posizione di sostituzione. Disordini dell'emoglobina possono manifestarsi anemia, Non apportare modifiche nel sangue o determinante aumento di emoglobina e globuli rossi.
La prima descrizione di emoglobina ristrutturata si riferisce a 1949 città, quando è stato scoperto, che l'emoglobina falciforme, movimento elettroforesi in ambiente alcalino con una velocità, a, di emoglobina adulta.
IN 1956 g utilizzando il metodo delle mappe peptidiche installato, emoglobina, rilevata al anemia falciforme e chiamato l'emoglobina S, Si differenzia dalla sano emoglobina umana Una modifica solo una singola catena di aminoacidi β-. Normalmente, nella sesta posizione di β-chain N-terminale è acido glutammico, e con emoglobinopatie S - valina aminoacido. Differisce responsabile dell'acido glutammico, emoglobina muove quindi in un campo elettrico ad una velocità inferiore.
La maggior parte delle emoglobinopatie non forniscono alcun manifestazioni cliniche nel eterozigoti, sia allo stato omozigote. Si osserva in quei casi, Quando aminoacidi sostituzioni non distruggono la struttura terziaria o quaternaria di emoglobina e di emoglobina funzioni di base vengono memorizzati. Alcune emoglobinopatie fornisce manifestazioni cliniche nello stato omozigote o in combinazione con talassemia. Talvolta i segni clinici della malattia sono trovate in eterozigoti portatori del gene anomalo in presenza di un gruppo di emoglobine anormali instabili. In questi riguarda emoglobinopatie cambio più funzionalmente importanti aminoacidi. Questi aminoacidi partecipa nella fissazione delle eme a globina, incollaggio insieme le catene globiniche.
Serpovidnokletochnaya anemia, Emoglobinopatia s, C sono ampiamente distribuiti in vari paesi in Africa. Alcune delle forme più comuni di emoglobinopatie sono emoglobinopatie anche E, DPanjab.Sostituzione di aminoacidi nella catena β si verifica molto più frequentemente, di α-catena.
Al fine di identificare emoglobina anomala è prima necessario stabilire la propria presenza nel paziente. Emoglobina S e emoglobine stabili rilevati mediante elettroforesi su pellicola di acetato di cellulosa, carta. Tuttavia, lo studio elettroforetico offre l'opportunità di identificare un 1/3 Parte di emoglobine anomale. Quando l'anemia, associato disgregazione della struttura di catene globiniche, diagnosi di emoglobinopatie collocato solo quando rileva segnali di instabilità emoglobina, spesso in assenza di variazioni nella mobilità elettroforetica.
Dopo i segni di emoglobina anomala è necessario separare in un modo o in un altro (elettroforesi, denaturazione termica, Cromatografia) da emoglobina normale A, chiarire la catena, dove vi è una sostituzione (metodi di catene idrolizzano, separazione elettroforetica cromatografica).
Il passo successivo è l'idrolisi trittico di catene anomale, Il peptide risultante mappe di chiarire peptide, in cui vi è un'anomalia, studio patologico della composizione amminoacidica del peptide, se necessario, per studiare l'ordine degli amminoacidi nel peptide.
Quando si parla di emoglobina, tranne il suo nome è una catena, dove vi è una sostituzione, indica il numero di amminoacidi nella catena (dalla fine dell'azoto), aminoacido titolo, che è a questo punto, e il nome del amminoacido, che doveva essere in questa regione. Per Esempio, Hb Eα2b226Glu → albero mezzi, stiamo parlando di emoglobinopatie E, dove la sostituzione avviene β-catena acidi 26 amino - acido glutammico alla valina.
Anemia, condizionata dell'emoglobina carrozza, modificare la struttura in ipossia
L'anomalia più comune della struttura dell'emoglobina è emoglobinopatie Sα2b26Glu → albero. Nel caso di omozigoti parlare di anemia falciforme, eterozigoti - sulle anomalie falce-cell.
Drepanocytemia diffusione in Africa (Angola, Mozambico, Congo, Liberia, Algeria, Tunisia e gli altri.). Spesso vi è una malattia in India, Ceylon, in Turchia, Ho Corso, Iraq, Cuba.
Il fenomeno di camber È una conseguenza della bassa solubilità di emoglobina, che ha dato ossigeno, rispetto all'emoglobina A. Emoglobina A, deoxygenated, mezzo solubile, di emoglobina A, ossigenato. La solubilità dell'emoglobina S per l'ossigeno diminuisce rendimenti 100 tempo. Ciò porta alla formazione di gel. Se l'esame microscopico rivela valore cristalli 1,5 m, simile ad una falce eritrociti. Cristalli, crescente in una direzione, chiamato taktoidami. Scompaiono se collegato a ossigeno dell'emoglobina. Si può presumere, che la sostituzione di acido glutammico nella sesta posizione di valina porta ad una maggiore comunicazione con una molecola di emoglobina in altri casi, quando una molecola di emoglobina non è attaccato all'ossigeno. Questo fornisce una bassa solubilità della molecola. La presenza di emoglobina nei globuli rossi C, DPanjab, Oarabo aumenta il fenomeno camber, mentre la presenza di emoglobina F in una grande quantità diminuisce il grado di falciforme.
Forma omozigote di emoglobinopatia s (drepanocytemia)
Clinicamente è caratterizzata da un'anemia normocromica moderata, trombosi, un particolare tipo di pazienti. Le prime manifestazioni della malattia si verificano fino a diversi mesi dopo la nascita, perché emoglobina fetale, che è la nascita principale, Non contiene patologico β-catena e non rotto. Inoltre, alti livelli di emoglobina fetale nei bambini dopo l'inizio del circuito patologica riduce il fenomeno di camber dovuta alla maggiore affinità per l'ossigeno.
Il sintomo più comune di anemia falciforme nella prima infanzia è la sconfitta delle ossa e delle articolazioni.
In connessione con trombosi vascolare polmonare, è frequente negli bambini infarto polmonare. Lo sviluppo di questo processo può essere accompagnato da un aumento della temperatura corporea a numeri elevati, aumento del numero di globuli bianchi. Forse lo sviluppo di infarto renale.
A volte, durante l'esacerbazione del processo nelle articolazioni o nei polmoni nei bambini sviluppare una grave crisi emolitica con sintomi di emolisi intravascolare con urina nero, con una netta diminuzione dei livelli di emoglobina, febbre alta. In età più avanzata, questi fenomeni sono spesso uniti da un forte dolore all'addome, complicazioni trombotiche associate con la malattia.
Emorragia del vitreo e distacco della retina spesso causare cecità.
La sconfitta del sistema nervoso può anche essere dovuto a trombosi, fornire diverse aree del cervello.
Nella prima infanzia la milza è ingrandita, inoltre si riduce, e dopo 5 anni splenomegalia è rara. Ciò è dovuto al sintomo caratteristico di anemia falciforme - autosplenektomiey, per fibrosi della milza a seguito di attacchi cardiaci si verificano spesso. Il fegato è spesso allargato.
Negli adulti,, affetti da anemia falciforme, a volte osservato priapismo, collegato, più probabile, la stagnazione del falciforme nei corpi cavernosi, cosa, a sua volta, ipossia e aumenta la formazione di cellule falciformi.
Quando un esame del sangue ha rivelato lieve espresso normohromnaya anemia: emoglobina 3,72-4,96 mmol / l (60- 80 g / l). Il striscio colorato a volte può essere identificato eritrociti falciformi, ma caratterizzato da un eritrociti punktatsii basofile, mišenevidnosti. Camber possono essere rilevate da test con metabisolfito di sodio, oppure applicando un laccio emostatico alla base del dito.
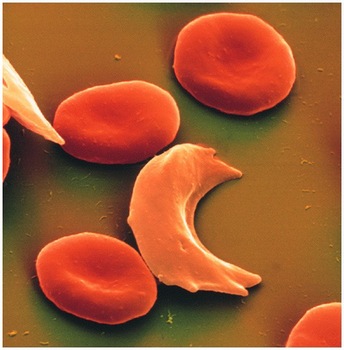
Il contenuto di reticolociti, erythrokaryocytes numero di midollo osseo e aumentato il livello di bilirubina indiretta, ESR è più spesso nel range di normalità, come gli eritrociti falce depositano lentamente, rispetto al normale.
Ci possono Sequestration crisi, in cui una parte significativa dei globuli rossi scomparire negli organi interni. Questo può portare al collasso, per il ritiro di che richiede una rapida trasfusione di sangue.
Descritto crisi aplastica, sotto che ha sviluppato una grave anemia, leucopenia, reticolociti scompaiono. Il più delle volte, vengono dopo infezioni virali gravi.
La maggior parte dei pazienti affetti da anemia falciforme muoiono nella prima infanzia. Un tasso molto alto di mortalità tra le donne incinte, affetti da anemia falciforme. Secondo alcuni rapporti, La mortalità materna in aplasia falciforme è 6 %.
Forma eterozigote di emoglobinopatia s (anomalia falciforme)
In questa forma di emoglobinopatie, i pazienti sono a volte inconsapevoli della loro malattia, emoglobina hanno normale, condizioni soddisfacenti. L'unico sintomo della malattia in alcuni pazienti è ematuria, associato a piccoli infarti vascolari renali. Il contenuto della emoglobina anomala nei globuli rossi di pazienti con la forma eterozigote di emoglobinopatie è piccolo, Le manifestazioni cliniche della malattia sono osservati solo durante l'ipossia, in caso di grave polmonite, durante l'anestesia, Quando si vola su un aereo senza pressione.
Manifestazioni trombotiche possono verificarsi in qualsiasi organismo, danni che si verifica anemia falciforme quando. Il fenomeno di camber rilevati in pazienti utilizzando campioni metabisulfatnoy. Elettroforesi dell'emoglobina ha rivelato due maggiori fazioni - emoglobina e l'emoglobina S.
La combinazione di emoglobinopatie eterozigoti forma S (anemia falciforme) с b-талассемией.
Frequente, È notevolmente più morbido, di omozigote β-talassemia e emoglobinopatie omozigoti S.
Caratterizzato da un significativo aumento della milza, eritrociti ipocromia espressi, un alto grado di mishenevidnosti. Complicanze trombotiche sono molto più rari, che con anemia falciforme. Forse JavaScript attacca dolori articolari, stomaco. C'è un ritardo nello sviluppo fisico. Caratterizzata da un significativo aumento del livello di emoglobina fetale. Se non l'emoglobina elettroforesi A, e l'emoglobina S può essere quasi l'unica dell'emoglobina. Β-талассемии При кроме Hb S, La2 e fetale emoglobina registrato.
Ad un alto contenuto di emoglobina F fenomeno camber espresso lieve.
Anemia, carrozza condizionata emoglobine anomale stabili
Le forme più comuni di anemia sono emoglobinopatie come C, DPanjab ed E.
Tutti questi tipi di emoglobinopatie eterozigoti e le loro combinazioni con loro o con manifestazioni cliniche talassemia non danno. In emoglobinopatie omozigoti con rilevabile espresso anemia emolitica lieve con ingrossamento della milza e dispepsia. Lo striscio dei globuli rossi vengono rilevati mishenevidnye. Con emoglobinopatia dPanjab che si verificano nello stato omozigote è estremamente rara, emoglobinopatie ed E si trovano in stato omozigote espresso lieve anemia emolitica, un leggero allargamento della milza. La combinazione di tutti e tre i tipi di emoglobinopatie talassemia determina un quadro molto più grave clinica e un marcato aumento nella milza.
Tutte e tre queste specie sono caratterizzate da sostituzione nel emoglobina β-chain. In gemoglobine C 6 è un glutaminovoy unità kislotы sostituito lisina, gemoglobine in E-26 è un kislotы unità glutaminovoy - lisina, In emoglobina dPanjab 121-L'unità è glutaminovoy kislotы - glutammina.
Mobilità dell'emoglobina DPanjab Corrisponde alla mobilità di emoglobina S, ma a differenza di emoglobinopatie S per emoglobinopatie DPanjab È prove normali per solubilità e di falce. La mobilità è la stessa di emoglobina E, nonché la mobilità di emoglobina A2, ma la quantità di emoglobina A2 mai così, E come in emoglobinopatie.
La malattia si verifica in Africa occidentale, Tacchino, Ho Corso, India (Punjab).
Emoglobinopatie E si trova in India, Cambogia, Birme, Indonesia.
Anemia, causato da anomala dell'emoglobina carrozza instabile
Sotto emoglobine instabili capiscono queste emoglobine anomale, che a causa della instabilità delle molecole precipitare negli eritrociti, che porta allo sviluppo di anemia emolitica in eterozigoti portatori del gene anomalo.
Eziologia e la patogenesi
IN 1952 g. Cathie ha descritto un bambino con congenita anemia emolitica, che, dopo splenectomia in tutte le cellule rosse del sangue di vitello rilevato Heinz. Solo più tardi, 18 è stato trovato anni, che la causa di queste cellule è frazione emoglobina anormale. Inizialmente, questo gruppo di malattie chiamato congenita anemia emolitica con vitelli Heinz.
Prima struttura dell'emoglobina instabile è stato installato Hbzurigo, trovato in 1962 g. due pazienti, dopo crisi emolitica acuta dopo l'assunzione di sulfamidici.
Studio ha trovato, la parte della emoglobina nei pazienti con vitelli Heinz facilmente precipitare un leggero riscaldamento. IN 1969 g. è stato proposto un nuovo nome per questo gruppo di malattie - anemia emolitica, carrozza condizionata emoglobine instabili.
Questo tipo di anemia sono ereditate in modo dominante. L'instabilità della molecola dell'emoglobina trovato in casi, Quando sostituzioni aminoacidiche riferiscono alla comunicazione con eme globina, un связи- e catene β-globina insieme, e quando vi è una sostituzione di aminoacidi, entrare in una spirale di emoglobina, aminoacido prolina, che a causa della particolare struttura non può entrare in una spirale.
L'instabilità di Hb molecola viene rilevato in casi, quando la porzione globina della molecola, che è adiacente alla heme, la cosiddetta tasca dell'eme, amminoacido polare (glicina, valina, alanina e simili.) è sostituita dalla polare (glutammico, acido aspartico e altro.). In questo caso, la tasca dell'eme penetra la molecola d'acqua, violare la stabilità della molecola dell'emoglobina.
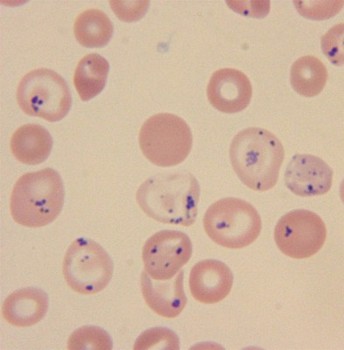
Instabilità Emoglobina Essa può anche essere dovuta ad una delezione di uno o più aminoacidi o allungamento subunità. Questo porta alla deformazione della molecola di emoglobina e la rottura della sua stabilità. Di conseguenza, in alcune forme di emoglobinopatie in eritrociti apparire corpuscoli più-inclusione, a causa della precipitazione di emoglobina instabile. In altri casi, i globuli rossi sono trovati in isolato vitello Heinz, che rappresenta un dell'emoglobina, privo di eme, o precipitare catene globiniche isolati.
Manifestazioni cliniche
Le manifestazioni cliniche di anemia sono varie e dipendono dalla posizione della sostituzione aminoacidica.
Alcuni pazienti con emoglobina normale, in altri è ridotta a 2,48-3,72 mmol / l (40-60 G / l). Nel caso di grave malattia o ad una gravità media di anemia emolitica manifestazioni cliniche osservato nell'infanzia. Il grado di ittero, nonché il grado di anemia, Essa dipende dalla natura della sostituzione aminoacidica ed è diverso: in alcuni pazienti con il colore della pelle e sclera normale, in altri è un grave yellowness costante o intermittente. La milza è ingrandita nella maggior parte dei pazienti, Tuttavia, alcune forme di emoglobinopatie rimane normale. Forse un aumento nel fegato. Questa anemia è spesso complicata da colelitiasi. Variazioni nello scheletro possono essere uguali, come in microspherocytosis, in forme lievi di anemia sono assenti.
Gli esami di laboratorio
Quando portatori di emoglobine instabili rivelato anemia di gravità variabile, spesso normocromica, a volte ipocromica, a causa della perdita di una parte di emoglobina precipitata, specialmente in quei casi, quando l'eme è scisso dal globina o quando il precipitato è composto da singole catene. Mishenevidnost globuli rossi si trovano, anisocitosi, polihromaziya. Il contenuto di reticolociti sempre sollevato. Ci irritazione crescita rosso midollo.
L'immagine del sangue e cliniche manifestazioni di emoglobinopatie Essa dipende solo dalla natura della sostituzione aminoacidica. Gli stessi pazienti con emoglobinopatie, non un parente - portatori di emoglobina anomala dà le stesse manifestazioni cliniche. Così, emoglobinopatie a Biba, Savana, Casper, Volga osservato clinica grave anemia emolitica, Con emoglobinopatie Tacoma, Belfast, Casper, Mosca ha manifestazioni cliniche minime. Quando parte delle emoglobinopatie cambia affinità per l'ossigeno.
Più gemoglbinopaty con maggiore affinità dell'emoglobina per l'ossigeno è caratterizzata dalla sostituzione aminoacidica nei contatti tra l'α- e β-catene (un1b2-contatti). Maggiore affinità per l'ossigeno può anche essere causa di sostituzioni di amminoacidi, relativo al legame di 2,3-difosfoglicerato - Sostanza, necessaria per l'emoglobina normale ritorna ossigeno ai tessuti. Quando emoglobinopatie, associata ad un aumentato affinità per l'ossigeno, grazie al tessuto ipossia può verificarsi policitemia, invece di anemia. Dove, quando l'affinità per l'ossigeno si abbassa, Anemia può verificarsi, non a causa di un aumento emolisi, e iperossia. In questi casi, non è la natura della emolitica, ed è associata con livelli ridotti di eritropoietina.
Emoglobinopatie Diagnosi
Emoglobinopatie Diagnosi, causato da trasporto anormale globine instabili, Ha basato sulla, che quando esposti a vari agenti ossidanti eritrociti, per esempio, un brillante blu cresile, Una qualche forma di emoglobina instabile erano denaturato e precipitato sotto forma di piccole inclusioni di più.
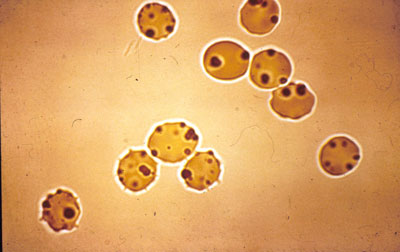
Le stesse inclusioni presenti nelle emoglobinopatie H, ANCHE, Mosca. Questa colorazione è comunemente usato per determinare la reticolociti. Per una chiara identificazione delle inclusioni incubazione richiesto più 2 no.
Un certo numero di pazienti nel colore come ossidante, e coloranti non ossidanti (ad esempio,, Cristallo viola) negli eritrociti rivelato unico grande toro Heinz, disposti eccentricamente. Essi sono più spesso visto in pazienti, splenectomia sottoposti.
La ricerca metodo termolabilità emoglobina Egli è nella, che in condizioni di riscaldamento a 55 ° С при pH 7,4 in 0,15 M tampone fosfato normalmente attraverso 1 h precipita una media di circa 13 % Emoglobina, in presenza di una emoglobina instabile - altro 25 %.
Metodo rapido di individuazione di emoglobina instabile, È come segue. Situato nel emolisato di sangue 17 % soluzione di alcool isopropilico in tampone Tris e incubate a temperatura 37 ° C. In presenza di una emoglobina instabile precipitati entro 5-15 minuti, mentre normalmente appare solo in 30-40 minuti.
Reagenti: 17% soluzione di isoprene- Alcol Pilov in 0,1 Buffer M, Tris Solyanaya Chislot (pH 7,4). La soluzione può essere conservato per lungo tempo in un vaso sigillato.
Metodo. Gemolizat, contenente circa 6,21 mmol / l (100 g / l) Emoglobina, preparato da lavate tre volte con soluzione isotonica di cloruro di sodio addizionato con 1-1,5 eritrociti in volume con acqua distillata. I globuli rossi scuotimento emolitica, I lipidi sono estratti con una metà del volume di tetracloruro di carbonio sotto agitazione per 2 m. Dopo centrifugazione 10 minuti a 3000 giri / min per lo strato superiore è studio separato.
La soluzione è stata versata in alcool isopropilico 2 ml 2 tubi, Spine chiusi. I tubi sono riscaldati a una temperatura 37 ° C bagnomaria. In uno dei tubi viene versato 0,2 ml emolisato, ottenuto da eritrociti paziente, in un altro - 0,2 ml emolisato, ottenuto da eritrociti donatori. In presenza di una emoglobina instabile precipitati entro 5-15 minuti. Ci possono essere dei falsi positivi. Se impreciso, maggiore concentrazione di alcol, temperatura più elevata con tubi di riscaldamento, pH più acido emoglobina normale può precipitare in precedenza 30 m. Ad alte concentrazioni di metaemoglobina sedimenti possono verificarsi a causa della minore resistenza rispetto a metaemoglobina ossiemoglobina.
Per studiare la stabilità di emoglobina con questo metodo deve essere utilizzato solo emolisato fresco. Dovrebbe essere presa in considerazione, che la concentrazione di emoglobina deve essere vicino a 100 g / l.
Attualmente, viene utilizzata l'elaborazione rilevamento emoglobina instabile β-mercuribenzoate o β-chloromercuribenzoate, seguita da elettroforesi in gel di amido.
IN 1981 g. come un metodo rapido proposto un nuovo metodo per la determinazione dell'emoglobina instabile, Basato su, In presenza di basse concentrazioni di sali di zinco emoglobina instabile viene precipitato ad una temperatura 37 ° C over 15 min a differenza di emoglobina normale. Così, in una quantità hemolysate 0,2 ml (6,21 mmol / l, o 100 g / L di emoglobina) è stato aggiunto ad una soluzione di, comprendente 0,35 ml 0,003 Soluzione M di acetato di zinco e 1,45 ml 0,1 M tris-tampone a pH 7,4. Dopo la miscelazione, il tubo viene posto in un forno a 30 minuti a 37 ° C. In presenza di una emoglobina instabile appare immediatamente precipitare, che si deposita su 30 m.
In alcune emoglobinopatie dopo preincubazione sangue per 1-2 giorni, e talvolta nuovi contenuti metaemoglobina nel sangue è aumentato.
Per mobilità elettroforetica (in uno studio su carta o acetato di cellulosa) L'emoglobina A è diverso da solo un terzo dei noti emoglobine instabili. In alcuni casi possibile identificare cambiamenti nella mobilità elettroforetica del gel amido o polakrilamidnom. Uno studio della struttura primaria di emoglobina instabile impostare accuratamente il tipo.
