Mehanizam djelovanja ljekovitih tvari
U velika većina slučajeva,, ljekovita tvar (Liganda) utječe, Mora ispuniti određene komponente u tijelu-ciljne receptore, strukture molekula, koji predstavlja su proteini, rjeđe nukleinske kiseline, lipidne ili druge konfiguracije, koji se nalaze unutar ili na površini stanica, s kim je u interakciji, pokretanje lanca biokemijskih i fizikalno-kemijskih procesa, dovodeći do određenog učinka.
Postoje dvije vrste membranskih receptora – ionski kanali i receptori, G protein spregnut. Na Primjer, Adetilkolin i slični lijekovi karakterizirani su natrijevim kanalom. Acetilkolin stupa u interakciju s proteinom kanala, uzrokujući konformacijske promjene u njemu, koji pospješuju otvaranje kanala i prodiranje natrijevih iona u stanicu. Ovaj proces je u osnovi živčanog uzbuđenja. Neki lijekovi, u interakciji s proteinom natrijeva kanala, spriječiti otvaranje, čime se blokira prijenos živčane ekscitacije.
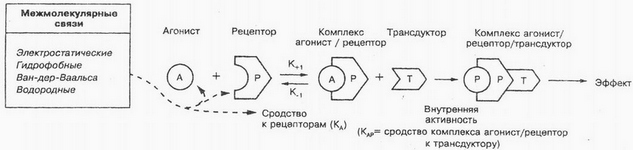
Takozvani G protein pričvršćuje se na unutrašnjost stanične plazma membrane., koji osigurava sinkronizaciju procesa interakcije lijekova uz istodobnu aktivaciju odgovarajućih intracelularnih ciljnih proteina. Kao što slika pokazuje, molekula lijeka stupa u interakciju s receptorom (P) na vanjskoj površini membrane, što uzrokuje konformacijske promjene proteina receptora. Zbog toga G protein mijenja svoju prostornu strukturu, migrira u ravnini membrane na enzime, koji su unutar stanice u neaktivnom stanju. Interakcija G proteina s enzimima (T) uzrokuje njihovu aktivaciju (LV/R/T). Norepinefrin, dopamin i drugi ligandi specifično komuniciraju s receptorima, G-protein spregnut. Treba napomenuti, da acetilkolin može djelovati ne samo s proteinom kanala, ali i s receptorima, G-protein spregnut.
Da bi došlo do interakcije između liganda i bioreceptora, potrebno je, tako da imaju komplementarnost, odnosno između njih mora postojati određena srodnost, odnosno afiniteta (podudaranje veličine, prostorna konfiguracija, prisutnost suprotnih naboja itd.. d.). Na Primjer, pozitivni naboj egzogenog liganda mora odgovarati negativnom naboju receptora, a nepolarni radikali tvari mogu se vezati za hidrofobne regije receptora.
Među fizikalno-kemijskim svojstvima ljekovitih tvari, utječući na njihovu interakciju s receptorima, treba istaknuti veličinu molekule, ovisno o tome tvar može djelovati s cijelim receptorom ili s njegovom komponentom. O veličini molekule lijeka ovisi i kinetika njegova prodiranja kroz biološke membrane.. Tipično, kako se veličina molekule povećava, povećava se njezina fleksibilnost i mogućnost stvaranja van der Waalsovih veza s makromolekularnim partnerom.. Osim, Važna je stereokemija molekule lijeka. Iz, U kojem je izomernom obliku lijek?, ovisi o njegovoj farmakološkoj aktivnosti. I trebate imati na umu: što je konformacija receptorske molekule rigidnija, veća je razlika u učinku stereoizomera.
Interakcija lijek-receptor odvija se preko međumolekularnih veza. U početku se tvar privlači receptoru pomoću elektrostatskih sila, a u prisutnosti komplementarnosti, stvara veze s receptorom pomoću fizičkih i fizikalno-kemijskih interakcija (tipično za ljekovite tvari, koji se nepromijenjeni ili malo promijenjeni izlučuju iz organizma) ili kemijske interakcije (svojstvena vezama, koji u tijelu prolaze kroz kemijske transformacije). Najslabije van der Waalsove sile sudjeluju u određivanju specifičnosti interakcije lijeka s biokemijskim reaktivnim sustavima. Vodikove veze sudjeluju u procesima prepoznavanja i fiksacije tvari (od liganda) na biostrukture. Ionske veze nastaju kada, kada ljekovite tvari sadrže kationsku ili anionsku skupinu, a suprotne strukture nalaze se u bioreceptorima. Ionske veze često se stvaraju u prvim fazama farmakološke reakcije između tvari i receptora. U takvim slučajevima učinak lijeka je reverzibilan. Važna je tvorba koordinacijskih kovalentnih veza. Uz njihovo sudjelovanje dolazi do interakcija alkilirajućih sredstava s biosupstratima, kao i lijekovi i protuotrovi s metalima u stvaranju stabilnih kelatnih kompleksa, npr, unitiola s arsenom ili tetacin-kalcija s olovom. Učinak takvih tvari je nepovratan.
Osim, postoji hidrofobna interakcija. Iako je energija njegovih veza mala, interakcija velikog broja dugih alifatskih lanaca dovodi do nastanka stabilnih sustava. Hidrofobne interakcije igraju ulogu u stabilizaciji konformacija biopolimera i formiranju bioloških membrana.
Aminokiselinski ostaci u molekuli proteinskog receptora sadrže polarne i nepolarne skupine, koji određuju stvaranje polarnih i nepolarnih veza između njih i ljekovitih tvari. Polarne skupine (-OH, -NH, GUGUTATI-, -N3H, =O) pružiti obrazovanje, uglavnom, ionske i vodikove veze. Nepolarne grupe (vodik, metil, ciklički radikali itd.) tvore hidrofobne veze s lijekovima niske molekulske mase.
Tako, interakcija lijekova sa specifičnim receptorima može se provesti zahvaljujući različitim kemijskim vezama, imajući nejednaku snagu. Tako, približna snaga tvari sličnih kurareu s kolinergičkim receptorima za elektrostatičku (ionski) interakcija iznosi 5 kcal/mol, ionski dipol - 2-5 kcal/mol, dipol-dipol - 1-3 kcal/mol, vodikove veze - 2-5 kcal/mol, van der Waalsove veze - 0,5 kcal/mol, hidrofobne veze - 0,7 kcal po CH2-skupina. Smanjenje čvrstoće veze kao funkcije udaljenosti između atoma za elektrostatsku interakciju je r-2, ion-dipol - r-3, dipol-dipol - r-4, vodikove veze - r-4, van der Waalsove obveznice - r-7. Ove vrste veza mogu biti prekinute, što osigurava reverzibilnost djelovanja lijekova. Kovalentne veze su jače, koji osiguravaju dugoročne i često nepovratne učinke tvari, npr, alkilirajući lijekovi protiv raka. Većina lijekova reverzibilno se veže za receptore. U čemu, obično, priroda veze je vrlo složena: može istovremeno uključivati ionske, dipol-dipol, van der Waals, hidrofobne i druge vrste veza, što je uvelike određeno komplementarnošću tvari i receptora te, odnosno, stupanj njihove međusobne bliskosti.
Snaga vezanja tvari za receptore naziva se "afinitet". Tvari, djelujući na iste receptore, mogu imati različite stupnjeve afiniteta prema njima. U tom slučaju, tvari s većim afinitetom mogu istisnuti tvari s nižim afinitetom iz povezivanja s receptorima. Za određivanje stanja ravnoteže između "zauzetih" receptora (DR), slobodnih receptora i slobodne tvari (D) koristi se konstanta disocijacije (KD), što je određeno sljedećom formulom:
KD=[D]*[R]/[ DR]
Negativan logaritam od KD (pRD) je pokazatelj afiniteta. Indikator pD često se koristi za karakterizaciju afiniteta2, t. je. negativni logaritam od EC50, (koncentracija tvari, u kojoj proizvodi učinak, formiranje 50% od maksimalnog učinka).
Raznolikost veza kemijskih interakcija i njihova nejednaka snaga, ili se afinitet između liganada i bioreceptora objašnjava složenom strukturom lijekova, koji sadrže radikale različite reaktivnosti i imaju višedimenzionalni volumetrijski oblik, kao i složenost procesa interakcije, često se odvija u nekoliko faza (fazama): stvaranje kompleksa lijek-receptor; intramolekulsko grupiranje; disocijacija kompleksa.
Tako, farmakološki učinak mogu izazvati samo tvari s izraženim afinitetom prema bioreceptoru. Ozbiljnost učinka ovisi o koncentraciji ljekovite tvari i ukupnom broju receptora.
Ako tvari imaju dovoljnu unutarnju aktivnost, onda se nazivaju agonisti. Intrinzična aktivnost odnosi se na sposobnost agonista da izazovu biološki učinak promjenom konformacije receptora., t. je. sposobnost liganda da aktivira receptor. Ovaj fenomen se smatra afinitetom kompleksa agonist-receptor za transduktor, transformacija vanjskih signala u unutarnje naziva se transdukcija. Unutarstanični prijenos signala leži u osnovi takvih procesa, poput kontrakcije mišićnih vlakana, dioba stanica, proliferacija, diferencijacija itd.. Sada je uspostavljena, što je s mnogim tvarima (hormoni, bioaktivni peptidi, Nukleotidam, steroidi, bioregulatori niske molekulske mase itd.) stanica ima specifične receptore. Kao rezultat interakcije ovih tvari s tim specifičnim receptorima, nastaju sekundarni glasnici (posrednici), koji pokreću kaskadu biokemijskih reakcija.
Postoji koncept "parcijalni agonisti» - ljekovite tvari, da, vezanje za receptore, ne daju maksimalan učinak. Ovaj zagonetni fenomen vjerojatno se objašnjava nepotpunim (u) ovisnost afiniteta kompleksa lijek-receptor o transduktoru. Na Primjer, djelomični agonist opijatnih receptora nalorfin djeluje slično punom agonistu opijatnih receptora morfiju, iako slabiji od posljednjeg. Istodobno, kada se koristi zajedno, nalorfin slabi ili eliminira učinke morfija; posebno, eliminira se inhibitorni učinak morfija na disanje. Izoprenalin je pravi agonist, a prenalterol je djelomični agonist za β-adrenergičke receptore. Prema receptorskoj teoriji, pravi agonist može inducirati maksimalan odgovor, čak i ako stupa u interakciju samo s dijelom receptora.
Specifični receptori mogu imati ista ili različita mjesta vezanja za agoniste i antagoniste. Moguća različita mjesta vezanja za različite agoniste. U tom slučaju, kada agonist i antagonist imaju ista mjesta vezanja i blokirajući učinak antagonista na receptor je potpuno eliminiran povećanjem koncentracije agonista (postiže se maksimalan učinak agonista), odnos između antagonista i agonista naziva se konkurentski antagonizam. Ako su vezna mjesta za agonist i antagonist različita, tada se odnos među njima definira kao nekonkurentski antagonizam. Indikator pA često se koristi za karakterizaciju antagonista2 (negativni logaritam molarne koncentracije antagonista, u kojem se za dobivanje standardnog učinka agonista njegova koncentracija mora udvostručiti).
U uvjetima cjelokupnog organizma agonisti i antagonisti uzrokuju promjene pojedinih fizioloških funkcija. Djelovanje antagonista u ovom slučaju određeno je, da ometaju utjecaj odgovarajućih prirodnih liganada na specifične receptore (npr, antagonist M-kolinergičkih receptora atropin ometa djelovanje njihovog agonista acetilkolina). Promjene, koji su izravno povezani s međudjelovanjem tvari s određenim receptorima, označava se terminom “primarna farmakološka reakcija, što može biti početak čitavog niza reakcija, što dovodi do stimulacije ili inhibicije određenih fizioloških funkcija".
Promjene u funkcijama organa ili sustava (npr, promjene u snazi i učestalosti srčanih kontrakcija, tonus glatkih mišića unutarnjih organa, izlučevine žlijezda, Dovraga, itd.), izazvana lijekovima, označen kao farmakološke učinke ove tvari. Tako, za srčane glikozide, primarna farmakološka reakcija je inhibicija aktivnosti prijenosa Na+, K-ATF-ili vlakna miokarda, koji se smatra mogućim specifičnim receptorom za srčane glikozide. S tim u vezi dolazi do poremećaja ulaska K+ u mišićna vlakna i izlaska Na+ iz vlakana., Povećava se sadržaj Ca2+ u citoplazmi, koji pospješuje međudjelovanje aktina i miozina. Rezultat ovih promjena je povećanje snage srčanih kontrakcija, koji je glavni farmakološki učinak srčanih glikozida.
Dugotrajni učinci agonista na specifične receptore često su popraćeni smanjenjem njihove osjetljivosti. Ovo posljednje može biti povezano s promjenama u receptorima, smanjenje njihovog broja (gustoća) ili poremećaj procesa, koji slijede stimulaciju receptora. Istodobno, farmakološki učinci agonista postaju manje izraženi.
Tako, farmakološki učinci većine lijekova povezani su s njihovim djelovanjem na odgovarajuće specifične receptore.
Tvari s visokim afinitetom za bioreceptor i niskom unutarnjom aktivnošću nazivaju se antagonistima, odnosno blokatora, budući da oni, bez izazivanja promjena u konformaciji bioreceptora, spriječiti interakciju endogenih i/ili egzogenih agonističkih liganda s njim. Postoje i takozvani "sekundarni ili tihi receptori", na koje se vežu lijekovi, ali nemaju farmakološki učinak. Takvi "tihi" receptori najčešće su prisutni u proteinima i krvnoj plazmi (ali se mogu naći i u tkivima). Povezivanje s "tihim" receptorima dovodi do smanjenja koncentracije slobodne tvari lijeka, a samim tim i do smanjenja terapijskog učinka.
Brojne moderne teorije, objašnjavajući mehanizam interakcije ligand-receptor, stanje samih receptora, nedostatak proporcionalnosti između broja okupiranih receptora i konačne reakcije, promjene učinkovitosti prijenosa signala i postojanje rezervnih receptora i parcijalnih agonista itd.. d. stvorio temelj za ideje o mehanizmu djelovanja predstavnika različitih skupina ljekovitih tvari. Te se interakcije dijele na receptorske interakcije i kemijske interakcije.
Mehanizam interakcije lijekova s bioreceptorima može se prikazati kao sljedeći dijagram: svaki ligand (lijek ili fiziološki supstrat) veže se na određeno mjesto na specifičnom receptoru. Aktivirani receptori izravno ili neizravno reguliraju protok iona (1) i/ili drugi unutarstanični procesi (sekrecije ili kontrakcije mišića) ili aktivira sustav proteina koji veže guanin nukleotid (G proteini), što, zauzvrat, pojačava aktivaciju sustava drugog glasnika enzima. U citoplazmi djeluje nekoliko različitih sekundarnih glasnika, aktiviranje različitih ciljnih proteina, npr. bjelančevine- kinaza. Potonji djeluju na specifične supstrate i posreduju u farmakološkom učinku.
Iz prezentiranog opisa jasno je, da se djelovanje ljekovitih supstanci odvija putem sljedećih mehanizama:
- fiziološke funkcije tkiva (npr, kontraktilna, sekretorni) može regulirati više receptora, i time, i razni ligandi;
- Može postojati nekoliko međukoraka između interakcije lijeka i receptora i odgovora tkiva ili organa, posebice aktivacija sustava drugog glasnika povezanih s receptorima;
- učinkovitost mehanizama, odgovoran za slijed podražaj-odgovor, a gustoća receptora može varirati od tkiva do tkiva.
Terapeutski učinak nekih ljekovitih tvari je zbog njihovog izravnog (nisu povezani sa specifičnim receptorima) kemijska interakcija s endogenim spojevima ili drugi mehanizmi interakcije (osmolalnost, adsorpcija). Dakle za osmotske diuretike - manitol, urea – nema specifičnih receptora. Ove tvari povećavaju osmotski tlak u bubrežnim tubulima, zbog toga je poremećena reapsorpcija vode i pojačana diureza. Djelovanje adsorpcijskih tvari nije povezano sa specifičnim receptorima, diuretici koji stvaraju kiselinu.
Antacidi (npr, aluminijevih ili magnezijevih hidroksida) reagiraju s klorovodičnom kiselinom stvarajući proizvode sa slabo kiselim svojstvima. Sredstva za keliranje, vezivanje s određenim metalima, stvaraju neaktivne kemijske komplekse.
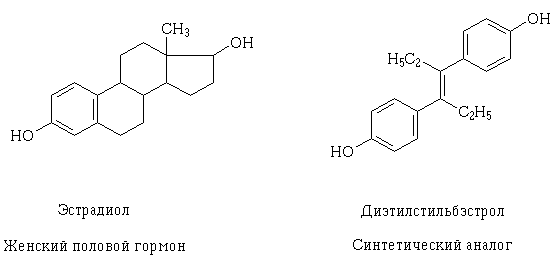
Kako su se spoznaje o strukturi receptora i mehanizmu moguće farmakodinamičke interakcije lijekova na staničnoj razini produbile, postalo je moguće njihovo ciljano stvaranje, kao i objašnjenje, Zašto ljekovite tvari mogu imati slično djelovanje?, drugačiji, na prvi pogled, njegovu strukturu. Primjer ovog fenomena je estradiol i trans izomer dietilstilbestrola, sintetskog analoga ženskog spolnog hormona.. Njihove strukturne molekule su različite, но содержат одинаковые по свойствам и размерам функциональные оксигруппы, сходно расположенные и ориентированные в пространстве, zbog čega molekule tih tvari mogu komunicirati s istim receptorom i imati slične farmakološke učinke.
Metode, kojim ljekovite tvari izazivaju određene farmakološke učinke, обозначают термином «механизмы действия». Это понятие используют для объяснения действия лекарственных веществ на молекулярном, органном и системном уровнях. Na Primjer, механизм действия антихолинэстеразных средств на молекулярном уровне сводится к блокаде ацетилхолинэстеразы путем взаимодействия с ее анионным и эстеразным центрами. Istovremeno, объясняя механизм гипотензивного действия антихолинэстеразных средств, указывают в качестве причины этого эффекта брадикардию и расширение сосудов, t. je. рассматривают механизм данного эффекта на органном уровне.
Исследования механизмов действия лекарственных веществ ведутся постоянно, причем представления о механизме действия того или иного лекарственного вещества по мере получения новых данных могут не только становиться более детальными, но и существенно изменяться.
