Определение количественных и качественных особенностей сперматозоидов
Определение подвижности сперматозоидов
Определение подвижности сперматозоидов является важнейшим параметром, характеризующим качество эякулята. Сперматозоиды, способные к оплодотворению, обладают подвижностью — совершают прямолинейное поступательное движение со скоростью 50 мкм/с. В эякуляте можно обнаружить сперматозоиды с нарушениями подвижности — дискиноспермией в виде колебательных, манежных и других видов движения, которые в норме отсутствуют.
Подвижность сперматозоидов оценивают в нативном препарате эякулята при ограниченном поле зрения (с помощью окошка Фонио), используя окуляр 7Х и объектив 40X, при полуопущенном конденсоре. Подсчитывая 100 клеток, отмечают количество среди них подвижных, малоподвижных и неподвижных сперматозоидов. В норме активно-подвижные сперматозоиды составляют 80—90 %, малоподвижные — 10—12, неподвижные — 6— 10 %. Учитываются только те активно-подвижные и малоподвижные сперматозоиды, которые совершают поступательные движения вперед.
Можно использовать и более развернутую пятибалльную шкалу оценки:
- «4» — отличная подвижность (все сперматозоиды обладают прямолинейной поступательной подвижностью со значительной скоростью);
- «3» — хорошая подвижность (несколько сниженная);
- «2» — посредственная подвижность (много неподвижных сперматозоидов, но с вибрирующими хвостами);
- «1» — плохая подвижность (отсутствие поступательного движения, подвижность только хвостов сперматозоидов);
- «0» — движение сперматозоидов отсутствует.
Фертильность эякулята зависит от продолжительности подвижности сперматозоидов, поэтому необходимо определять подвижность сперматозоидов в динамике (динамическая кинезисграмма).
Каплю эякулята наносят на покровное стекло, переворачивают его и кладут на предметное стекло с луночкой для висячей капли таким образом, чтобы капля оказалась в центре углубления. Края покровного стекла смазывают жидким парафином и под микроскопом определяют процент активно-подвижных, малоподвижных и неподвижных сперматозоидов через 1, 3, 6, 12 и 24 ч после эякуляции. Исследование проводится при комнатной температуре. В норме количество активно-подвижных сперматозоидов снижается через каждые 2—3 ч на 20 % ,
- Примечание. Микроскопическое исследование эякулята должно проводиться в лаборатории одним лицом, обладающим достаточным опытом в этой области лабораторной диагностики, так как результаты определения подвижности сперматозоидов у разных исследователей колеблются до ±40 % и во многом зависят от опыта работы с эякулятом.
Проба на «оживление» сперматозоидов
Проба на «оживление» сперматозоидов основана на восстановлении нормальной подвижности неподвижных, но живых сперматозоидов с помощью стимулирующих растворов:
1) раствора Бекера (глюкоза — 3 г, Na2HPO4 — 0,6 г, NaCl — 0,2 г, KH2PO4 —0,01 г, дистиллированная вода до 100 мл; pH — 7,8);
2) 0,1 % раствора кофеина (только не в ампулах!) — 10 % от объема эякулята;
3) 0,1 М раствора аргинина.
Методика. Мерной пипеткой емкостью 1 мл насасывают 0,1 мл эякулята (хорошо перемешанного) и этой же пипеткой набирают 0,9 мл стимулирующего раствора. Содержимое пипетки выдувают на часовое стекло, хорошо перемешивают путем многократного всасывания и выдувания жидкости на часовое стекло, а затем готовят препараты висячей капли. Через 5— 10 мин неподвижные, но живые сперматозоиды начинают двигаться.
Процент подвижных сперматозоидов определяют сразу же при восстановлении подвижности и спустя 3, 6, 12 и 24 ч. Для получения более достоверных результатов проводят параллельную пробу с двумя стимулирующими растворами. Только при условии невозможности «оживить» неподвижные сперматозоиды можно говорить о некроспермии.
Выявление живых сперматозоидов среди неподвижных
Принцип метода основан на том, что ферменты живых сперматозоидов обесцвечивают эозин. В качестве реактивов используются 5 % водный раствор эозина калия и 10 % водный раствор нигрозина.
Методика. На предметное стекло наносят маленькую каплю эякулята, рядом помещают вдвое большую каплю 5 % раствора эозина калия и каплю 10 % раствора нигрозина, которая также в два раза больше капли эозина калия. Сначала эякулят смешивают с эозином калия, выжидают несколько секунд, а затем смешивают с каплей нигрозина, опять выжидают несколько секунд и делают тонкие мазки шлифованным предметным стеклом.
Используя иммерсионную систему микроскопа, в мазках подсчитывают не менее 200 сперматозоидов, выделяя живые (бесцветные) и погибшие (окрашенные эозином в красный цвет). Количество живых и погибших сперматозоидов выражают в процентах. При отсутствии нигрозина каплю эякулята смешивают с каплей 5 % раствора эозина калия и готовят тонкие мазки для микроскопии. Нигрозин окрашивает только фон препарата, на котором сперматозоиды выделяются более контрастно. В норме живые сперматозоиды составляют 80—90 % от общего их количества.
Подсчет сперматозоидов в 1 мл и во всем объеме эякулята
Количество сперматозоидов в 1 мл и во всем эякуляте подсчитывается в счетной камере Горяева.
Количество сперматозоидов во всем эякуляте определяют путем умножения числа сперматозоидов в 1 мл на количество эякулята (в миллилитрах).
- Примечание. В счетной камере можно также определить число подвижных сперматозоидов, для чего эякулят следует развести теплым изотоническим раствором хлоридз натрия и подсчитать число неподвижных сперматозоидов, а затем вычесть их из общего числа.
В норме в 1 мл эякулята содержится 60—120 млн. сперматозоидов, при гиперспермии — более 120 млн., при олигоспермии — от 30 до 60 млн., что, как правило, делает оплодотворение невозможным. Однако описаны случаи, когда оплодотворение наступает и при содержании в 1 мл эякулята от 5 до 30 млн. сперматозоидов.
В любом случае при выявлении олигоспермии необходимы 2—3 контрольных подсчета числа сперматозоидов с интервалами времени в 3—4 недели для установления их максимального количества. У одного и того же мужчины число сперматозоидов подвержено значительным физиологическим колебаниям.
В норме во всем эякуляте содержится более 150 млн. сперматозоидов.
Подсчет сперматограммы
Сперматограмма — это процентное соотношение различных морфологических форм сперматозоидов и клеток сперматогенеза.
В мазке, окрашенном гематоксилинэозином или по Паппенгейму, подсчитывается не менее 200 сперматозоидов, при этом количество нормальных и патологических форм, а также клеток сперматогенеза выражается в процентах. Подсчет производится с использованием иммерсионной системы микроскопа и машинки для подсчета лейкограммы с предварительно измененными названиями клавишей.
В нормальном эякуляте нормальные формы сперматозоидов составляют 80—85 %, иногда 100 %, в их число входят физиологические варианты, которые характеризуются или необычно суженной, или уменьшенной, или увеличенной головкой.
Молодые, или незрелые, формы сперматозоидов имеют вокруг головки и шейки остаток цитоплазмы («воротничок»), наблюдаются при частых половых сношениях и не способны к оплодотворению.
Старые формы сперматозоидов (гиперхромия, ахромия, вакуолизация головки) появляются в эякуляте после продолжительного полового воздержания и не пригодны для оплодотворения.
К патологическим формам относятся сперматозоиды с деформациями головки: мегалосперматозоиды (гигантосперматозоиды), макро-, микросперматозоиды, конические, двуглавые сперматозоиды с одной шейкой и одним хвостом, без шейки с одним или несколькими хвостами, без хвоста, с хвостом без головки и пр.
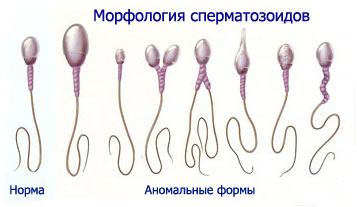
У здоровых мужчин в нормальном эякуляте патологические формы сперматозоидов обычно не встречаются, но иногда их количество при нормальной оплодотворяющей способности эякулята может достигать 20 %, из них приблизительно 15 % составляет патология головки, 3—5 % — тела, 2—5 % — хвоста.
При патологическом сперматогенезе, секреторной форме бесплодия выявляются сперматозоиды с патологией головки и шейки. Патология хвоста обычно экскреторного происхождения, возникает при прохождении сперматозоида по семявыносящим путям.
В окрашенных препаратах также четко просматриваются отдельно расположенные герминативные клетки на разных стадиях дифференцировки и созревания, что имеет важное значение для дифференциации аспермии и азооспермии.
Сперматогонии имеют округлую, иногда овальную форму, диаметр их 5—12 мкм. Ядро занимает приблизительно одну треть клетки, темно- или светлоокрашенное, с 1—2—3 нуклео- лами, часто расположенными вблизи кариолеммы (ядерной оболочки), структура хроматина мелкозернистая. Цитоплазма узкая, базофильная, гомогенная. Сперматогонии несколько раз митотически делятся. Встречаются клетки с хорошо определяемыми стадиями митоза.
Часть клеток, образовавшихся в результате митоза, дифференцируются в сперматоциты I, а затем II порядка. Сперматоциты I порядка — круглые или полигональные клетки диаметром 17—19 мкм с крупным круглым ядром и светлой мелкозернистой цитоплазмой. В окрашенных препаратах видна четкая перинуклеарная зона.
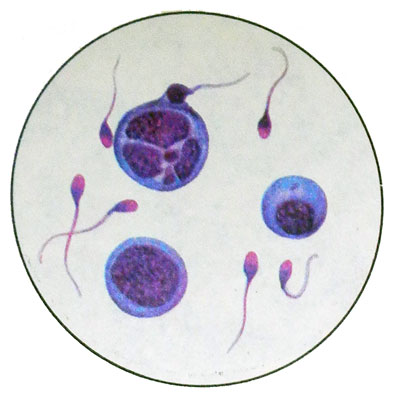
Сперматоциты II порядка образуются в результате мейоза. Они меньше, чем сперматоциты I порядка (диаметр 15 мкм), но по морфологии почти идентичны. В эякуляте встречаются чаще, чем сперматоциты I порядка, но значительно реже, чем сперматиды.
Сперматиды — мелкие, круглые или вытянутой формы клетки диаметром 12—15 мкм с круглыми гиперхромными ядрами, расположенными центрально или эксцентрично. Возможно наличие многоядерных сперматид. Цитоплазма клеток бледная, базафильная, нередко вакуолизированная.
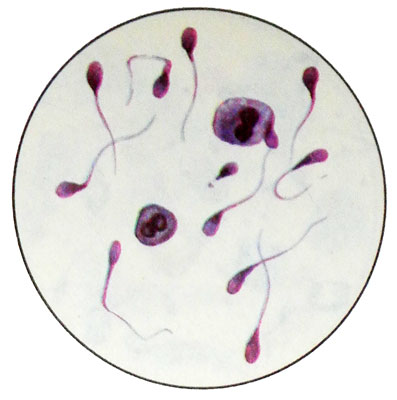
Сперматиды превращаются в сперматозоиды.
Клетки сперматогенеза в нормальной сперматограмме составляют не более 2 %. Большое количество их наблюдается при бесплодии секреторного характера.
Для фазово-контрастной микроскопии эякулят разводится изотоническим раствором хлорида натрия с добавлением небольшого количества 1 % водного раствора риванола или карболовой кислоты для снижения подвижности сперматозоидов.
При люминесцентной микроскопии на предметное стекло наносится одна капля эякулята и одна капля акридинового оранжевого в разведении 1:20000. Капли смешиваются и накрываются покровным стеклом. Для микроскопии используются окуляр 7Х и объектив 40Х. Живые сперматозоиды окрашиваются в зеленый цвет, погибшие — в оранжевый. Нормальные и патологические формы сперматозоидов легко различить вследствие их морфологических особенностей.
Правила работы на фазово-контрастном и люминесцентном микроскопах описаны в инструкциях к этим приборам. При использовании фазово-контрастной и люминесцентной микроскопии сперматограмма подсчитывается по общим правилам.
На основании микроскопического исследования эякулята можно выявить различные патологические состояния.
- Аспермия — отсутствие в эякуляте сперматозоидов и клеток сперматогенеза.
- Азооспермия — отсутствие сперматозоидов при наличии клеток сперматогенеза.
- Астеноспермия — уменьшение числа подвижных клеток и увеличение числа патологических форм при нормальном общем количестве сперматозоидов.
- Олигоастеноспермия — уменьшение числа сперматозоидов и их подвижных форм и увеличение количества патологических форм.
- Некроспермия — неподвижность всех сперматозоидов в препарате даже после «оживления».
- Акиноспермия — состояние, при котором в отличие от некроспермии ранее неподвижные сперматозоиды после «оживления» начинают активно двигаться.
