혈관 혈소판 지혈의 연구
지혈이 수준의 위반은 출혈 경향 또는 혈전증 발생할 수 있습니다, 에 따라 방법이 연구를 선택. 게다가, 모든 연구 방법의 혈소판 지혈은 일차 및 이차로 나누어, 또는 제 2 직렬 테스트, 경우에만 적용되는, 사용 테스트를 위반 한 것으로 밝혀졌습니다 경우. 주요 (bazïsnım) 다음의 시험은.
저항 샘플 (취성) 모세 혈관 - 커프스, 항아리, angiorezistometriya
이 시험, 충분히 정보를 아직 가장 접근에서 Konchalovsky - 경운기 - LEED 샘플.
추정 수와 출혈의 크기에 이루어집니다, 팔뚝의 손바닥 표면의 상부에 형성 (직경 원 5 센티미터) 압력 커프 어깨 12-13,3 kPa의에서 압축 5 분 후 (90-100 mmHg로. 미술.). 결과를 통해 고려 5 커프스의 제거 후 최소. 번호 점상 더 10 미세 혈관의 증가 된 취약성을 가리키는, 종종 혈소판 감소증 또는 혈소판과 연관된 기능을 손상 angiotroficheskoy되는. 또한 계정에 칼라에서 출혈의 발생, 오른쪽 소요.
Banochnaya 샘플 계층에 구축 부압에 피부의 같은 지역에서 수행되는 -에서 20 kPa의 (150 mmHg로. 미술.) 낮은. 결과를 평가, 점상 출혈, 은행에 나타났다.
모세관 출혈의 지속 시간과 크기의 샘플
고전에서 듀크 시험 3.5-4 mm의 깊이로 관통 그녀의 빛 온난화 후 낮은 롤러 귓불. 이 연구에서 출혈은 일반적으로 초과하지 않는 4 M, 여과지에 혈액의 방울은 비교적 낮으며 천자 후 약 1-1.5 분 이후 급격히 감소하기 시작. 혈소판 감소증을 표현하는 경우 (적게 20 T에 1 L) 혈소판 기능 장애 및 심한 출혈 시간 20 ~ 40 분으로 증가, 혈액 얼룩은 훨씬 더 큰, 그리고 장기간의 감소 또는 파도를 감소, 다시 증가. 듀크 샘플은 충분히 구분하지 않습니다, 에 2/3 thrombocytopathies 환자는 정상적인 결과를 얻을 수.
더 민감한 테스트, 있는 출혈 시간이 인위적으로 만들어 정맥 울혈의 배경에 조사한다, 어깨하는 혈압을 측정하고 연구 기간에있어서의 커프 압을 지원 중첩, 같은 5,3 kPa의 (40 mmHg로. 미술.). 이러한 정체의 배경에 대하여 Borchgrevink 샘플-Vaaler 팔뚝 란셋의 상단 3 분의 손바닥 표면에 가로 절개 깊이를 적용 1 mm 8-10 mm의 길이 (출혈 시간의 속도 - 최대 10 M), 아이비 등의 알을 샘플링. 팔뚝 란셋에 적용되는 동일한 세 개의 가로의 손가락 구멍의 깊이에서 혈액을 채취 3 MM (출혈 시간의 속도 - 최대 7 M).
수행 같은 정맥 울혈의 배경 에 관한 연구. FROM. Shitikova, 이에 말단 지골에이 녀석 깊이를 적용 3 MM, 다음, 손가락 끝은 컵에 침지 5 등장 성 염화나트륨 용액 ㎖의 투과광에서 카운트 출혈 시간 (이 솔루션은 집중적으로 피로 얼룩진 경우, 손가락에 후속은 다른 컵으로 이동). 손실 된 혈액의 양이 컵 내의 액체의 체적의 증가에 의해 결정된다 (출혈 시간의 속도 - 최대 4 M, 혈액의 부피가 손실 -로부터 0,01 에 0,4 ml의).
T의 시험에서. N. Shushkevich 손실 된 혈액량은 암모니아의 색에 의해 결정된다 (0,04 %) , 이는 혈액 얼룩 종이를 담근다, 의료 비색계에 색채로.
출혈의 지속 기간에 대한 표시 테스트, 이상, 학대의 증거는 혈소판 혈관 지혈을 표현, 그러나, 이들 샘플의 결과에 따라 정상적인 온화한 thrombocytopathy 표현의 존재를 배제하지 않는다.
혈소판의 수를 카운팅
혈소판의 수를 카운팅 (위상차 또는 색조에 따라 계산 실, 또는 입자 계수기의 도움으로 Goryaeva) - 가장 중요한 방법은 혈소판 감소증과 thrombocytopathy를 진단, 이러한 세포의 수가 일정한주기 또는 감소를 흐르는 (이상 버나드 - SOULIER, 메이 Hegglina 등.).
혈소판의 수가 또한 계산 제안, 그들의 더 기능적 연구를 어떤 방식으로 수행 할 수 있는지의 여부가 이루어져야 (농축 혈소판 유무에 관계없이, 광도 또는 현미경 등. D.).
혈액 도말 검사에서 혈소판의 크기에 대한 연구 – trombotsitometriya
혈액 도말 검사에서 혈소판의 크기에 대한 연구 (trombotsitometriya) 그것은 당신이 시험의 혈액에서 세포의 다양한 인구에 예비 판단을하고 이상 현상의 수에 대한 정보를 얻을 수 있습니다, 혈소판 과립뿐만 아니라 포화.
일부 thrombocytopathy에서 (Wiskott-Aldrich 사 증후군) 혈소판은 매우 작은 의해 지배된다 (에 2 직경 미크론), 다른 사람 동안 - 거대한 형태 (이상 버나드 - SOULIER, Meah-Hegglina) -하려면 8 m 이상의. 이러한 세포의 숫자에 가난한 thrombocytopathy 과립은 (센티미터. 이하), 혈소판에 집중 깨진 구슬 유리에 확산 - 다른 사람은 동안, 즉 과립 반응의 방출의 위반을 구성하는 그들은 물질을 포함, 지혈의 구현에 필요한. 이러한 모든 특성, 및 확산하고 형성 프로세스 혈소판 기능, 이러한 셀의 구조는 종래의 평가 및 주 사형 전자 현미경을 사용하여 조사 할 수있다, 그리고 노멀 스키 광학의 간섭에 의해.
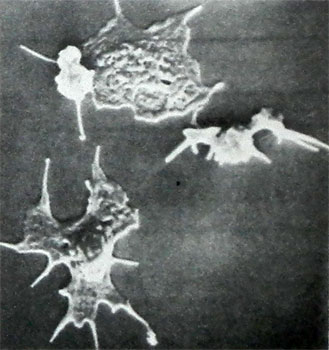
혈액 응고의 후퇴 정기적으로 심한 혈소판 감소증으로 위반 (미만 30 ~ 40에서 T 1 L) 혈소판의 질적 열등감의 어떤 형태의, 가장 자주 - 때 trombotsitoastenii Glanzmann, 요독 thrombocytopathy 등.
혈소판의 연구 접착제 응집 (AAFT)
혈소판의 연구 접착제 응집 (AAFT) - 대부분의 thrombocytopathy 실험실 진단의 가장 중요한 요소. 쉽게 구현 가능하고 공개 된 연구 방법의 현재 수, 시각적 포함, 현미경 및 하드웨어 (aggregometry, 마이크로 필터 등이있다.) 이 등록 기능은 다음 방법을 포함하도록 나타낼 수있다.
유리에 혈소판의 보존 방법 (또는 필터)
혈소판 수는 이전과 유리 비즈와 함께 열 또는 유리 섬유 피그 통해 표준 속도로에 통과 한 후 정맥혈 수행 하였다; 혈액에서 혈소판의 감소는 접착의 정도에 판단.
더 사용할 수, 다소 덜 정확하지만, 전과 플라스크의 내면에 일정 기간 내에 접촉 후 혈중 혈소판들의 개수를 결정하기위한 방법, 일정한 속도로 회전. 지연 혈소판 밀리 포어 필터를 결정하기위한보다 정확한 방법 (구멍 직경 - 15 ~ 20 미크론). 이들 테스트에서 평가 위 및 아래에 필터 압력 구배의 증가로 수행 될 수있다 (막힌 모공과 혈소판 응집이 지수의 증가로 연결).
혈소판의 응집을 공부하는 방법
Hemolysate 응집 시험 haemolysate 능력에 기초하여 적혈구를 세정, 번식 조사 10-2 과 10-6, 자신의 혈장에서 응집을 일으키는 교반하면서, 혈소판의 수가 원 (시트르산 플라즈마 hemolysate 부피비 - 1,0:0,2). 계정에 집계의 발생 시간을내어 (hemolysate-11-17 높은 농도의 비율, 낮은 - 40-54으로) 그 심각도. 프로세스 및 그 강도의 역학은 측광과 같이 추정 할 수있다 (의료 비색계, 녹색 필터, 교반) 어떤 디자인 agregografe.
언제 높은 희석 haemolysate의 사용 그래픽 기록 (10-6) 이 두 파장을 제공 agregatogrammu, 여기서 두 번째 물결은 내인성 혈소판 응집 자극제의 출시와 관련된 - ADP, 카테콜아민, 트롬 복산 등. 이 두 번째 물결은 릴리스의 반응에 의해 특징입니다, 이것은 혈소판 조밀 과립의 부재하에 관찰되지 (저장 영역 풀 질환) 또는 반응을 위반 해제 (아스피린 같은 증후군 등이있다.).
Hemolysate 응집 시험은 실험실에서 수행 할 수 있습니다, 그것은 특별한 시약을 필요로하지 않는다.
혈소판 응집의 시각적 micromethod 결정
그것의 본질은 사실에있다, silikonirovaniya 정맥 혈액에서 얻은 더블 볼륨을 안정화 3,8 % 시트르산 나트륨 (비 2,4:0,6 ml의), 그것은 원심 분리 6 분 100 V / / 분, 얻어진 혈소판 풍부 혈장에 의해인가 0,02 유리 슬라이드에 응집제 용액과 동일한 부피로 처리 - ADP, 트롬빈, 콜라겐, 노르 아드레날린 또는 ristomycin. 테스트 플라즈마에서 응집제의 최종 농도는해야한다:
- ADF 0,5*10-4 밀리몰 / ℓ;
- 노르 아드레날린 - 0,015%;
- 트롬빈 - 0,125 U / ㎖ (콜라겐의 농도는 실험적으로 선택되고).
낮게 아마도 테스트, 응집제의 높은 농도. 농도의 선택은 다른 샘플의 다양 요철 생산 활동의 제제의 활성에 따라 달라질 수, 관련있는 정상 플라즈마에 각 에이전트의 농도를 사전에 맞게.
Смесь богатой тромбоцитами плазмы крови агрегирующего агента перемешивается покачиванием предметного стекла, на темном фоне с помощью лупы регистрируется время появления агрегатов в виде «снежной бури». При оценке результатов учитывается число тромбоцитов в плазме. 그래서, время АДФ-агрегации, возрастает с 27—37 с при 400 T에 1 л тромбоцитов до 62—75 с при 50 T에 1 L, а тромбин-агрегации — соответственно с 40—52 до 79— 106 부터.
Графическая регистрация процесса агрегации
Графическая регистрация процесса агрегации под влиянием тех же агрегирующих агентов — весьма информативный метод функционального исследования тромбоцитов. Выполняется на агрегографах или.
При графической регистрации определяют не только время наступления агрегации, но и ее интенсивность (по величине отклонения кривой и площади агрегатограммы), наличие первой и второй волны агрегации — при использовании малых концентраций адреналина и АДФ (вторая волна характеризует реакцию освобождения), а также патологической дезагрегации.
Визуальное или графическое исследование агрегации тромбоцитов под влиянием ристомицина
Весьма важным является визуальное или графическое исследование агрегации тромбоцитов под влиянием ристомицина. Нарушается этот вид агрегации (конечная концентрация ристомицина 0,8—1,0 мг/мл) при одном из наиболее распространенных геморрагических диатезов — ангиогемофилии (болезни Виллебранда), 뿐만 아니라 혈소판의 이상 버나드 - SOULIER 및 폰 빌레 브란트 인자의 억압 합성 일부 인수 형태 (요독증, 면역 억제하고 있으므로. D.).
Количественное определение фактора Виллебранда в плазме крови
Количественное определение фактора Виллебранда в плазме крови проводится по ристомицин-агглютинации взвеси нормальных формалинизированных тромбоцитов в различных разведениях исследуемой бестромбоцитарной плазмы.
Метод важен как для диагностики ангиогемофнлии и вторичного угнетения синтеза этого фактора, так и для оценки тяжести поражения эндотелия (혈관염, атеросклероз и др.) и наклонности к тромбозам, при которых содержание фактора Виллебранда в крови часто значительно повышается.
Уровень фактора Виллебранда свидетельствует о способности эндотелия синтезировать его (снижен при аигиогемофилии) и о степени поражения эндотелия при васкулитах, атеросклерозе и других заболеваниях, протекающих с поражением внутренней оболочки сосудов.
Для получения фиксированных нормальных тромбоцитов к богатой тромбоцитами плазме крови здоровых лиц добавляются последовательно 0,2 % раствор ЭДТА (0,5 ml의 5 мл плазмы) 에 의해 2 мин — фиксирующий раствор (20 ml의 40 % формалина в 1000 мл фосфатного буфера с 0,2 г ЭДТА, pH를 6,4).
Смесь выдерживается при температуре +4°С не менее 1 아니, после чего она подвергается центрифугированию, удаляется надосадочная жидкость, а тромбоцитарный осадок дважды отмывается суспензирующим раствором (один объем 3,8 % раствора цитрата натрия и пять объемов изотонического раствора хлорида натрия; pH доводится до 7,4). Приготовленная взвесь нормальных формалинизированных тромбоцитов фасуется по 1 мл и хранится при температуре —20°С. Калибровочная кривая разведения строится с использованием бестромбоцитарной нормальной плазмы, с образцами которой смешиваются формалинизированные тромбоциты. Далее в смеси определяется ристомицин-агглютинация. По калибровочной кривой определяется количество фактора Виллебранда в исследуемой плазме крови. Фиксированные тромбоциты лучше сохраняются при добавлении в консервирующий раствор небольшого количества азида натрия.
테스트, отражающие спонтанную агрегацию тромбоцитов
При обследовании больных с тромбоэмболиями или с повышенной наклонностью к тромбозу и ишемии в число основных методов включаются тесты, отражающие спонтанную агрегацию тромбоцитов, 티. 그것은. возникающую в цельной крови или в плазме крови без добавления агрегирующих агентов.
Для выявления этого феномена при микроскопии мазка крови обращается внимание на соотношение числа отдельно лежащих тромбоцитов и их агрегатов, состоящих из 3—5 тромбоцитов и более. Этот феномен лучше выявляется при просмотре осадка, полученного при интенсивном цеитрифу- гировании богатой тромбоцитами плазмы (20—30 мин при 6000 / 분), EDTA 또는 시트르산, 시트르산 나트륨으로 안정화. 그러나,보다 안정한 결과 자발적인 응집을 결정하기위한 다음의 방법을 제공한다.
Метод 우 Hoak
를 기반으로 우 Hoak 방법, что кровь из вены набирается в две пробирки, в одной из которых содержится раствор ЭДТА, а в другой — смесь такого же раствора ЭДТА с 4 % раствором формалина. После перемешивания содержимое пробирок отстаивается 30 실온에서 최소.
Во время отстаивания агрегаты оседают, а отдельные тромбоциты остаются в надосадочном слое. После отстаивания подсчитывается число тромбоцитов в надосадочном слое в каждой из пробирок. В норме разница в количестве тромбоцитов в содержимом обеих пробирок не превышает 10—15 %, при повышенной спонтанной агрегации она возрастает.
Метод Н. 과. Тарасовой
По методу Н. 과. Тарасовой (1984) убыль тромбоцитов из цельной цитратной крови в агрегаты учитывается после 3-минутного взбалтывания ее на встряхивателе АВУ-1 со скоростью 90—100 раз в 1 M.
В пробирку с 0,5 혈액 ml의, подвергавшейся встряхиванию, вводится 1 ml의 1 % раствора формалина в изотоническом растворе хлорида натрия. Вторая пробирка с контролем не подвергается встряхиванию, и в содержащуюся в ней кровь того же исследуемого через 3 мин также вводится раствор формалина.
Кровь в обеих пробирках отстаивается 30 M, после чего в надосадочном слое подсчитывается число тромбоцитов. В норме разница в количестве тромбоцитов не превышает 20 %, при повышенной наклонности к агрегации она возрастает.
В случаях выявления нарушении при применении основных тестов, характеризующих тромбоцитарный гемостаз, выполняют по мере необходимо провести дополнительные исследования. Из них наиболее важны следующие.
Дополнительные исследования для определения тромбоцитарного гемостаза
Исследование количества мегакариоцитов в миелограмме и трепанате костного мозга с изучением морфологии этих клеток
Значительное увеличение числа мегакариоцитов в срезах костного мозга, обычно сочетающееся с более или менее выраженным увеличением количества тромбоцитов в крови, наблюдается при эритремии, геморрагическом и эссенциальном тромбоцитозе и других миелопролиферативных заболеваниях. Умеренный мегакариоцитоз, сочетающийся с тромбоцитопенией, характерен для тромбоцитопенической пурпуры (болезни Верльгофа).
При аплазии и гипоплазии костного мозга любого генеза снижено как содержание мегакариоцитов в срезах костного мозга, так и количество тромбоцитов в периферической крови.
Парциальный амегакариоцитоз наблюдается при дефиците тромбоцитопоэтина (редкая форма врожденной тромбоцитопении), появлении в крови антимегакариоцитарных антител, эссенциальной парциальной аплазии мегакариоцитов (может предшествовать развитию лейкоза).
Морфологические и цитохимические изменения мегакариоцитов отмечаются при многих тромбоцитопатиях.
Электронно-микроскопическое изучение ультраструктуры тромбоцитов
Электронно-микроскопическое изучение ультраструктуры тромбоцитов имеет значение для диагностики ряда тромбоцитопатий, при которых отсутствуют или резко уменьшается количество небелковых гранул высокой оптической плотности (содержащих АДФ, 세로토닌, 카테콜아민, кальций и др.), либо белковых α-гранул, что характерно для ряда тромбоцитопатий, объединяемых в группу болезней пула хранения, или болезней отсутствия гранул.
Могут выявляться также дефекты в контрактильном аппарате (системе микротрубочек) и лизосомах тромбоцитов.
При сканирующей электронной микроскопии или исследовании тромбоцитов с помощью интерференционной оптики по Номарскому могут обнаруживаться также дефекты фиксации тромбоцитов на чужеродной поверхности, их распластывания на ней, образование отростков, централизация и секреция гранул, что характерно для многих видов тромбоцитопатий.
Определение антитромбоцитарных антител путем иммунофлюоресцент- ного исследования в суспензии тромбоцитов иммуноглобулина, связанного с этими клетками – метод Диксона
Этот сложный метод позволяет дифференцировать иммунные и неиммунные тромбоцитопении.
Однако при наиболее выраженных формах заболевания с резкой тромбоцитопенией он неприемлем, так как для определения связанного иммуноглобулина требуется достаточно большое (более 40—50 Г в 1 L) 혈소판.
Определение продолжительности жизни меченых аутологичных тромбоцитов
Определение продолжительности жизни меченых аутологичных тромбоцитов позволяет разграничивать тромбоцитопении с нормальной продолжительностью жизни тромбоцитов в циркуляции (약 9 박) и формы заболевания с укороченной продолжительностью жизни этих клеток.
Первые чаще всего связаны со снижением продукции тромбоцитов в костном мозге, вторые — с их ускоренной гибелью, либо с действием антитромбоцитарных антител (при аутоиммунных тромбоцитопениях продолжительность жизни тромбоцитов сокращается до нескольких часов), либо с интенсивной убылью этих клеток в агрегаты и тромбы при диссеминированном внутрисосудистом свертывании крови или массивных тромбозах (тромбоцитопении потребления).
Количественное определение содержания в плазме крови до и после агрегации тромбоцитарных факторов
Количественное определение содержания в плазме крови до и после агрегации ряда тромбоцитарных факторов — мембранного фосфолипидного фактора 3, содержимого α-гранул (антигепаринового фактора 4, β-тромбоглобулина, митогенного фактора тромбоцитов) и небелковых гранул высокой электронно-оптической плотности (세로토닌, 카테콜아민, ADF), а также кислых гидролаз.
Эти исследования дают представление о содержании в тромбоцитах соответствующих структур и их компонентов, об освобождении их в плазму в процессе агрегации, а также о внутрисо- судистой активации тромбоцитов, сопровождающейся выходом из тромбоцитов в плазму крови с повышением концентрации в последней компонентов плотных и α-гранул (антигепаринового фактора 4, β-тромбоглобулина и др.).
Методы количественного исследования тромбоцитарных факторов важны для идентификации ряда тромбоцитопатий (нарушений сохранности гранул и их компонентов, пареза реакции освобождения этих компонентов, повышения содержания их в плазме крови вследствие интенсивной внутри- сосудистой адгезии и агрегации тромбоцитов и др.). Ряд тромбоцитопатий характеризуются снижением содержания в мембранах тромбоцитов фактора 3 либо нарушением его доступности для участия в процессе свертывания крови.
Исследование биохимических особенностей тромбоцитов и отдельных их структур
Исследование биохимических особенностей тромбоцитов и отдельных их структур — стромы, C09BB10, митохондрий и т. 디. позволяют документировать связь разных видов патологии и дисфункции тромбоцитов с определенными видами ферментной недостаточности (дефицитом циклооксигеназы, тромбоксансинтетазы и пр.), с нарушением состава мембранных липопротеинов, необходимых для взаимодействия с агрегирующими агентами, 및 T. 디.
Подобные исследования доступны лишь хорошо оснащенным исследовательским лабораториям и поэтому в широкой практике не применяются.
