凝固止血 – 止血のシステム
血液凝固 - 複雑な酵素プロセス, タンパク質分解酵素の数を関与します, と非酵素タンパク質とリン脂質成分, 劇的に加速し、活性化を強化し、 酵素の作用.
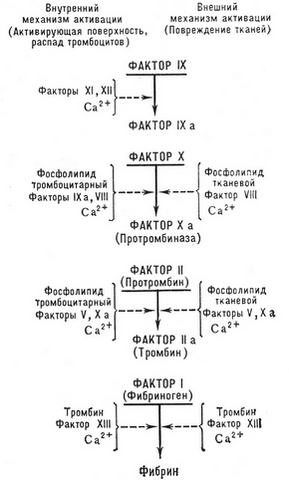
従来、血液凝固のプロセスは、2つの主要な段階に分けることができます:
- 初期のマルチ, プロトロンビンの活性化をもたらします (фактораII) トロンビン - 活性酵素に変換します (第IIa);
- 最後の, トロンビンの影響下で、フィブリノゲンをフィブリンモノマーおよびダイマーに最初に変換されます, とzatem - フィブリンポリマー中, 活性化第XIII因子安定します.
国際命名法によります, すべての凝固因子, ほかに – 血小板, ローマ数字 (表中の).
血液凝固因子の特性 | |||||
電子看板 | 最も受け入れられた名前 | 血漿レベル, G / L | アクティビティ, % | 静脈内投与後の血漿中半減期 | 最小, 止血のために必要な |
| 私 | フィブリノゲン | 1.8-4.0 | – | 3-5日 | 0,8 G / L |
| 二 | プロトロンビン | へ 0,1 | 80-120 | 3-4日 | 40% |
| 三 | 組織トロンボプラスチン | 0 | 0 | ? | – |
| 4 | カルシウムイオン | 0,9-1.2ミリモル/リットル | – | – | – |
| Ⅴ | AC-グロブリン (proakcelerin) | へ 0,01 | 70-150 | 18-24 | 10-15% |
| 七 | Prokonvertyn | " 0,005 | 80-120 | 4-6 | 5-10% |
| 8 | Antigemofilьnыйグロブリン (AGG)
| 0,01-0.02 | 60-250 | 12-18 | 30-35% |
| 9 | PTC-фактор (血漿トロンボプラスチン成分), クリスマス因子 | へ 0,003 | 70-130 | 20-30 | 20-30% |
| バツ | ファクタースチュアート·Prauera | " 0,01 | 80-120 | 48-56 | 10-20% |
| 11 | PTA-фактор (血漿トロンボプラスチン前駆), 血漿トロンボプラスチン前身 | " 0,005 | 70-130 | 60 いいえ | ? |
| 12 | ハーゲマン因子, 接触因子 | へ 0,03 | 70-150 | 2-3日 | もっと少なく 1 % |
| 13 | Fibrinstabiliziruyuschy要因 (fiʙrinaza) | 0,01-0,02 | 70-130 | 2-3日 | 2-5% |
| 血漿プレカリクレイン, フレッチャー因子 | へ 0,05 | 60-150 | ? | もっと少なく 1 % | |
| 高分子量キニノーゲン (WMC), フィッツジェラルド因子, 要因Flodzheka, 要因ウィリアムズ | へ 0,06 | 80-130 | ? | もっと少なく 1 % | |
示すために, これらの因子は、活性化に供しました, 数字係数は文字を追加されました«», ケースで; 有効成分活性因子は、そのフラグメントの1つになった場合, - "F"букваの
デジタルサイネージに加えて、その他の名前は、凝固因子が使用されている - それらの機能に応じて (例えば, 第VIII因子 - antigemofilьnыйグロブリン), 新たに患者の名前で: 因子の発見欠乏 (факторXII - Хагеманафактор, ファクターX - ファクタースチュアート-Prauera 等), 少なくとも - 著者名別 (例えば, フォン·ヴィレブランド因子).
血液凝固に対抗 プライマリー (独立して合成されました) と二次, 凝固および線維素溶解の間に形成されました 生理学的抗凝固剤.
フィブリン変換にフィブリノゲン
その最終段階で開始することをお勧め凝固の検討, 実際にあります, タンパク質分解酵素こと トロンビン, その不活性前駆体から得られました - プロトロンビン, フィブリノゲン分子から切断され4つのペプチド (二つのペプチドAとBの二つのペプチド), 4自由な接続をそれぞれ有するフィブリンモノマーの形成をもたらします. 二量体に - 最初の対で、互いにこれらの接続モノマーを接続することにより, した後、 - ポリマー中 (「エンドツーエンド」のタイプの化合物と「左右に」). フィブリン繊維が形成されています.
フィブリノゲン - globulyarnыy糖タンパク質 (分子量 340000), 2つの同一のサブユニットから成ります. 各サブユニットは、3つの鎖から構成されている - Aα, のBVиのC.
この分子の始まりは、ペプチドトロンビン切断します (DES-A-フィブリンモノマーを形成します), その後 - Bペプチド (DES-ABまたはフルフィブリンモノマー). 血液循環中の遊離ペプチドAの外観 (抗A血清を用いて免疫学的に決定) サインthrombinemiaと「証人」血管内凝固症候群として使用 (DICで, 大量の血栓症).
フィブリンモノマー trehnodulyarnuyu構造を有します, および化合物のポリマーは、形成ダイマーの手順を流れます, 長手方向及び架橋はプロトフィブリルを形成するの, その後 - フィブリン繊維が. この可溶性フィブリン5-7 M . 尿素または 2 % クロロ酢酸, 彼は、フィブリンSと呼ばれるものに関連して (水溶性の). XIII因子の影響を受けて, また、カルシウムイオンの存在下でトロンビンによって活性化されます, γ-間に追加のジスルフィド結合のようなフィブリン形成における, とα鎖, それを作ります. nerastvorimыmフィブリンに私がmochevine- (不溶性の).
通常の条件下では、持っています トロンビンの比較的適度な濃度 (例えば, 10〜12血漿の凝固を引き起こします) フィブリノーゲンのフィブリンへの完全な変換を提供します, この血清タンパク質および他の免疫学的方法で決定していないことにより.
対照的に、, プロセスで, 血管内凝固によって特徴づけられます, トロンビンへある程度損なわフィブリン重合プロセスモノマーに対する感受性の低下, それによってトロンビン凝固時間が長くなるとトロンビンの上記閾値用量は全フィブリノーゲン凝固されていません. これに違反した場合は、事実によるものです, 完全および不完全フィブリンモノマーの一部は、フィブリノーゲンと複合体を形成し、そして, 多分, プラスミンによるフィブリンおよびフィブリノーゲンの早期切断産物と. これらの高分子と MIDDLE可溶性フィブリンモノマー複合体 (RFMK), 文学だけでなく、「悪い凝固フィブリン」で参照されます, 「ブロックされたフィブリノゲン」, トロンビンの影響下で凝固悪いです (比較的抵抗性であるトロンビン), 血漿に添加した場合が、ゲルを形成します 50 % エタノール (エタノール試験), いくつかの試料の硫酸プロタミン, βナフトール溶液中の 50 % アルコール, 酸っぱいortofenantrolina.
非酵素的凝固SFMCの現象 (ロックされたフィブリノゲン) と呼ばれます 現象paracoagulation それは広く検査診断とthrombinemia血管内凝固に使用されています. 最も完全に次のテストを可能にするこれらの複合体を同定:
- 中央アジアヘビ毒エパと凝固検査;
- サンプルortofenantrolinom;
- ブドウ球菌の試験接着.
このようにして, フィブリノーゲンのフィブリンへの変換は、両方の従来の方法を行くことができます, とSFMCを形成します (製品paracoagulation), の同定は、血管内凝固の診断に不可欠です.
凝固過程の最終段階の総合評価 これは、トロンビンの試験によって行われます。, T. それはあります. それにトロンビンの標準量を添加することによりクエン酸血漿の凝固時間を決定することにより. 試験は、血液凝固の多くの疾患の診断のために重要です, 結果は、全ての他の凝固サンプルの証言の正しい解釈のために重要です, プロセスの最終段階を阻害するための他のすべての試験において凝固時間が長く、.
プロトロンビンのトロンビンへのメカニズム
複雑なカスケード凝固の近代的な理論によると, 活性化プロトロンビン (фактораII) これは、多酵素プロセスの結果であります, 前記連続的に活性化され、様々な凝固因子と相互作用. これらの要因のIII, 七, バツ, 9, XIIのи第XI, およびプレカリクレインは、タンパク質分解酵素であります, および第VIII因子, V - 非酵素的プロセスaktseleratorami, 酵素の活性化を促進することは何千回もの要因.
二つの主要なメカニズムが凝固プロセスを開始している - 外部および内部.
血液凝固のメカニズム外
血液凝固のメカニズム外 組織トロンボプラスチンによってトリガ, 影響を受けるの血漿に入ることができます (けが, 手術や他の。) 組織, 血管壁 (これは、活性化血小板の参加を得て、内皮障害によって生成されます), と組織液から血流に入ります (羊水塞栓症, 腹腔 - 静脈シャント, ショックの様々なタイプ). 直接血組織トロンボプラスチンに活性化単球によって産生され得ます (エンドトキシンの影響を受けて, 免疫複合体など. D。).
細胞やある種の癌によって産生される組織トロンボプラスチン、多数の (白血病を含みます).
現在の開始組織トロンボプラスチンはタンパク質であります - アポタンパク質 C言語, リン脂質部分III非特異的要因に対し、およびマトリックスを活性化する方法として機能します (T. それはあります. 要因と機能的に類似しました 3 血小板, kefalin, eritrofosfatidom).
回路凝固から見ました, カルシウムイオンとVII因子と複合体を形成する組織トロンボプラスチン, 最後を活性化させます, 酵素X因子の強力な活性化をもたらします.
実験室での試験ではプロトロンビン時間の外部機構をシミュレートします, クエン酸血漿を外部ファブリックに追加された再石灰化するための性能 (ヒトまたはウサギの脳の最も) 具体的な活動と記録された凝固時間をトロンボプラスチン.
血液凝固の内部機構
血友病AおよびB - 内部機構は、出血性素因、最も頻繁に臨床診療で遭遇するの病因と診断を解読するためのはるかに複雑かつ重要です, angiogemofilii, またはフォンウィルブランド病 (彼らはより多くを占め、 97 % すべての遺伝性出血性凝固障害).
と、内部血液凝固メカニズムを (プラズマ) 組織トロンボプラスチンの関与なしに実現.
このメカニズムの要因をトリガすることはXII因子であります (ハーゲマン), の活性化は、血液または外部表面との接触に起因します (ガラス, 金属, カオリンなど. D。), 内皮下のいずれか (コラーゲン) および他の結合組織成分, それは損傷した血管壁を観察し (機械的傷害, vaskulit, アテローム性動脈硬化症など. D。).
ほかに, 因子XIIの活性化は、その酵素的切断によって実施することができます (kallikreinom, プラスミンまたは他のプロテアーゼ). 従って, 因子XIIの活性化の2種類があります:
- と) ピン - XIIa因子を形成します;
- へ) 酵素 - 活性因子をXIIの断片を形成します (13).
要因XIIaの効果の間にいくつかの品質の違いがあります (主に血液凝固に影響を与えます) иXIII (これは、カリクレイン - キニン系及び線維素溶解活性化に大きな効果があります). 一般的には、第XII因子は、プラズマのタンパク質分解システムの普遍的な活性化因子である - 凝固, カリクレイン - キニン, fibrinoliticheskoyおよび補体sistemы.
初期で (コンタクト) 凝固プロセスの段階が行われます, 片側, プレカリクレイン - - 複雑XII因子で第XIIa因子およびカリクレインの相互活性化高分子量キニノーゲン, そしてその後 - 要因XIIaの複合体中の第XI因子の活性化 - XI - WMC.
最長のこの初期段階 (4/5 すべての凝固時間), 成長分野と外国表面と血液の接触時間で活性化 (静脈から血液を取った後silikonirovanii調理器具やより迅速な研究では、最小限の活性化, 最大 - dobavlenyy kaolynaで). それは考慮に入れることが重要です, 接触XII因子およびXIの活性化は、安定化されたシュウ酸塩またはクエン酸血漿で発生します, T. それはあります. これは、カルシウムイオンを必要としません. 血液凝固中のカルシウムの参加は、第IX因子の活性化の後に始まります, T. それはあります. 教育次のセット 2.
あなたはカオリンと十分な因子との最大接触を作成する場合 3 血小板またはkephaline (T. それはあります. 活性化部分トロンボプラスチンテスト中) 減衰率XI活性化および減速は、凝固因子欠損によって引き起こされる可能性がXII, 11. prekallikreina, 高分子量キニノーゲン (WMC). 第XI因子の最も一般的な欠乏, 他の障害は非常にまれです.
多くの場合、次の段階の欠陥に関連する凝固の内部機構の違反 - 因子IXおよびVIIIの活性化. 通常, これは、第VIII因子成分の不足に起因します, T. それはあります. 血友病Aおよびフォンヴィレブランド病または血管血友病と (約 93 % すべての患者), あまり頻繁に - 第IX因子欠乏症 (Bгемофилией).
クリニックの第VIII因子のための大きな価値は、その構造と機能に関するデータのより詳細なレビューが必要です.
現在のデータによると、, 第VIII因子は、タンパク質ポリマーであります, 同一のサブユニットの数からなります. サブユニットのそれぞれにおいて、以下の成分を含みます:
1) の凝固 (8: と) その抗原 (8: 犬);
2) フォン·ヴィレブランド因子 (FV) または補因子ristomitsinovoy血小板凝集 (8: FV, 8: PKOF) 抗原と (8: 心臓血管の, 8: 心臓血管/ FV);
3) 炭水化物部分と, たぶん, 別の未同定のタンパク質成分.
場所合成VIII:と 決まっていません, これは、遺伝子合成によって制御されます, X染色体に位置します; 血友病Aのその特性の単離された違反.
フォン·ヴィレブランド因子の合成 (FV) 常染色体によって制御される内皮でほぼ独占的に発生します, 因子は、内皮のマーカーとして使用されます; その血中レベルが急速に多くの血管疾患を増加させ.
フォンビルブランド因子またはその多量体構造の変化の欠乏は、血管血小板止血の違反であります (長引く出血, ガラスとコラーゲンまたはristomycin - 血小板凝集血小板付着の違反), 凝固VIIIの活性を低下させます:と. これらの障害は、異なるバリアントで異なる組み合わせで起こる血管血友病. 血液は、血漿中の両方のvWFが含まれています, および血小板 (-гранулахをв), これらの細胞の中に、彼はVIIIから解離しました:と. 血友病のレベルVIII:急激に減少すると, 一方、プラズマVIIIの内容:EFは通常のまま.
ФакторVIII:と - Nefermentnыйアクセル第IXa因子, それはリン脂質マトリックス上の複合体を形成すると. 活性化VIII:トロンビンのフィードバック低用量で (第IIa) と, たぶん, 第Xa因子; 従って、EFと解離します. トロンビン切断の活性化に続いて、および第VIII因子を不活性化します:両方と直接, および間接的にプロテインCの活性化を介して.
血液凝固の外部と内部機構との相互作用
血液凝固系の活性化の外部および内部機構の本体に分割されていません, と密接に相互作用. そう, 第XII因子 + калликреинактивируютфакторVII. 重要な役割は、第VIIa因子および第IXaの相互活性化によって再生されます, Xa及び第VIIaと.
第VIIa因子は、部分的に血漿リポタンパク質およびトリグリセリドとして活性化, と逆行トロンビン. このため、第VIIa因子の活性化および強化の同定は、血液凝固及び血栓形成の高い危険性の血管内活性化の全体的なマーカーであります, 特に冠状動脈性心臓病および高脂血症.
外部と同様に, および凝固の内部機構で 相互作用およびリン脂質mikromembranahで行われた因子の活性化, テンプレート, これは固定されています。 (カルシウムイオンを介して), その三次および四次構造を変更, 激しくお互いのタンパク質因子と反応. マトリックスの役割は、膜血小板膜および顆粒を行います (要因 3 血小板) 、および他の細胞膜からの同様の構成要素 (赤血球など。). かなりの程度まで、これらの膜リン脂質基質の存在が決定します, なお、他のものは、血漿凝固の間に等しいです, 血小板の少ないです, より長いです, 通常の血小板数と血漿の凝固時間より, その後, 何 gemoliz (赤血球膜の放出) 大幅に凝固を促進し、証拠の凝固試験を歪ま (血液凝固の研究に適していない血液を溶血しません).
による変動する条件にリン脂質起動指示非標準凝固試験は、非常に大規模なランダムな変動の対象となります. このスプレッドはあっても、等しくないため、強度が増加します (ガラス管の特性) と接触因子XIIの活性化の持続時間. 接触の凝固試験の標準化 (silikonirovaniyaのガラス製品の下または最大接触相カオリンのその後の活性化とPTFEチューブ内の血液の受信および処理) およびリン脂質の活性化 (kephalineの標準量添加します) それは彼らがはるかに正確で再現性の作っています.
へ 血小板凝固活性の評価 血小板の高および低含有量の血漿のカオリン凝固時間を比較すべきです (反応ケファリンから排除).
このようにして, カオリンおよびカオリンkefalinovym - あなたは一般的な研究凝固時間標準試験によって内部メカニズムで起動凝固プロセスの完全な評価 (活性化部分トロンボプラスチン時間), 二段階試験autokoagulyatsionnym.
同様に、活性化され、他の非酵素的凝固促進剤を不活性化 - V因子, 第X因子との相互作用. この複合体は、文献に呼ばれてprotrombinazy (血液トロンボプラスチン - 時代遅れの用語によって、), 酵素の活性は、多くの場合、第Xa因子であります, プロトロンビンをトロンビンにtransformiruyushtiy. リン脂質マトリックス中に (例えば, 血小板膜上) この複合体中のアクティビティ 1000 上記の回, リン脂質の非存在下におけるよりも. 複合体は、VA-Xa因子であります 3000 倍活性, 第Xa因子より. このようにして, Va因子およびリン脂質マトリックスが一緒に要素が分離された第Xa因子と比較して、中にプロトロンビンの活性を増加させます 300000 時間.
各血小板の表面には約持ちます 3000 リン脂質受容体複合体VA-Xa因子, 約その 1000 高親和性受容体. 凝固因子のすべての複合体のための行列は、リン脂質マイクロメンブレンケファロニアと赤血球膜として機能することができます (éritrocitin, eritrofosfatid), それは、広く研究室の実施に使用されます.
活性化因子すると、第Xaプロトロンビン活性αトロンビンに変換され、. したがって、順次切断断片から 1 遺跡 プレトロンビン 1, そしてその後 - 断片 2 遺跡 プレトロンビン 2. プロトロンビンの切断のような一本鎖分子は、二本鎖に変換して (иBцепи) -тромбинамолекулу. そして、後者の主題自己分解させると活性を失います, ならびに生理学的に不活性化アンチトロンビンとして.
他のエンドの影響を受けて- および外因性 (というようにヘビの毒と。) タンパク質分解酵素は、フォームのトロンビンを形成することができます, αトロンビン弱い凝固活性を特徴とします, 複雑なヘパリンに対する感度が低い - アンチトロンビンIIIおよびその他のプロパティ.
イオン化カルシウムは、血液凝固に必須です, それは、次のプロセスに関与しているので:
- 活性形態の凝固因子の分子配座;
- リン脂質マトリックス中に相互作用する因子を固定;
- それらを接合することによって、個々の因子の活性化を促進します (例えば, プロトロンビンのトロンビンへの変換は、Caを加速 で 1000 ただNH中の残基-karboksiglyutamilovymのγに接続することにより、2-分子の末端部分).
基本的な凝固試験の結果を分析する際には、次の点を考慮することが重要です:
- アッセイ系に使用される第VII因子は、プロセスの外部機構に関与します, それによって、それが唯一の赤字について拡張した場合- トロンビン時間;
- 第XII因子, 11, 9, VIIIおよびプレカリクレイン活性化の内部機構に参加, したがって、彼らは赤字のaPTTおよびACTに違反しているとき, プロトロンビン時間が正常であるのに対し、;
- 第X因子欠乏症, Ⅴ, IIのиI, これは凝固メカニズムの両方を閉じて, 上記のすべてのテストで明らかにした病理.
しかし、活性化の外部および内部機構が互いに分離されていません, 相互作用します.
そう, 第VII因子および第IX因子の相互活性化を発見し、X, ならびに第VII因子複合体第XIIa-カリクレインWMCの活性化. 内部と外部のメカニズム間のこれらの「橋」を含めることは、状態または潜在prethrombotic血管内凝固の診断基準の一つであります. これは、プラズマにそれをテスト中に血漿中の第VII因子の活性の増加によって検出されます, この要因を欠い, ならびにウシトロンボプラスチンとプロトロンビン時間の低温活性化の試験を経て.
凝固因子及び線維素溶解の多くは肝臓で合成されます. これらの要因のII, 七, XиIX, と抗凝固剤 - タンパク質CとSK- vitaminozavisimy: それらの合成の最終段階 (カルボキシル化) 赤字フィロキノンに違反 (ビタミンK) クマリン - と彼の拮抗薬の影響を受け, fenilinaなど. これは、肝細胞のK-vitaminozavisimoyカルボキシラーゼの教育を破壊し, 活性化する奪う凝固因子の能力. Opisan naslyedstvyennyi gyemorragichyeskii diatyez, その中カルボキシラーゼの合成の違反の結果、K-vitaminozavisimyh凝固因子のレベルを減少させました.
対照的に、, V因子および線維素溶解およびカリクレイン - キニン系の構成要素の数にかかわらず、フィロキノンの、肝臓で合成されます.
