Adveit: 薬の使用説明書, 構造, 禁忌
臨床および薬理学的グループ: 凝固第VIII因子薬
薬物療法グループ: 止血剤
Adveit: 薬理効果
第VIII因子/ウィルブランド因子複合体は2つの分子で構成されています (第VIII因子およびフォンウィルブランド因子), 異なる生理学的機能を持っている. この薬は、チャイニーズハムスター卵巣細胞の培養における組換え技術によって製造されました, 製造プロセス中にヒトまたは動物由来のタンパク質は添加されていません.
準備のアドバイス® 組換え凝固第VIII因子を含む (オクトコグアルファ), アミノ酸配列を持つ糖タンパク質です, ヒト第VIII因子に類似.
オクトコグアルファは糖タンパク質です, からなります 2332 おおよその分子量のアミノ酸 280 kDaの. 患者に投与すると、オクトコグアルファは内因性フォンウィルブランド因子に結合します。. 活性化第VIII因子は活性化第IX因子の補因子として作用します, 第X因子から活性化第X因子への変換を加速する. 活性化された第X因子は、プロトロンビンからトロンビンへの変換を促進します. トロンビン, 順番, フィブリノーゲンからフィブリンへの変換を促進します, これは血栓の形成につながります (血餅).
血友病Aは遺伝性です, ジェンダー関連, 第VIII因子活性のレベルの低下を伴う血液凝固系の違反. 関節への大量の出血によって臨床的に現れる, 筋肉または内臓, 自発的に, 外傷や手術の結果. 補充療法中、血漿中の第VIII因子のレベルが上昇します, その結果、血漿中の因子欠乏が一時的に修正され、出血が増加する傾向が減少します。.
Adveit: 薬物動態
Adveitのすべての薬物動態研究® 患者さんの参加を得て実施, 以前に重度または中等度の血友病Aの治療を受けた (ベースライン第VIII因子≤2%). 一般に, 要約薬物動態データは、 195 以前に治療を受けた患者, 重度の血友病A (ベースライン第VIII因子 <1%).
テーブル 1. Adveitの薬物動態パラメータ® 重度の血友病Aのさまざまな年齢層の患者 (ベースライン第VIII因子 <1%)
| オプション (平均±標準偏差) | 乳幼児 1 月-<2 年 (n = 5) | 子供2-<5 年 (n = 30) | 子供5-<12 年 (N = 18) | 十代の若者たち12-<18 年 (n = 33) | 大人 (n = 109) |
| AUC0-∞ (ME×h/dl) | 1362.1±311.8 | 1180.0±432.7 | 1506.6±530.0 | 1317.1±438.6 | 1538.5±529.1 |
| 調整されたC回復の蓄積マックス (IU / dl of IU / kg)* | 2.2±0.6 | 1.80.4± | 2.0±0.5 | 2.1±0.6 | 2.2±0.6 |
| T1/2 (いいえ) | 9.0±1.5 | 9.6±1.7 | 11.8±3.8 | 12.1±3.2 | 12.9±4.3 |
| C言語マックス 注入後の血漿中 (ME / dl) | 110.5±30.2 | 90.8±19.1 | 100.5±25.6 | 107.6±27.6 | 111.3±27.1 |
| 平均血漿循環時間 (いいえ) | 11.0±2.8 | 12.0±2.7 | 15.1±4.7 | 15.0±5.0 | 16.2±6.1 |
| Ⅴ(d) 平衡状態で (dl / kg) | 0.4±0.1 | 0.5±0.1 | 0.5±0.2 | 0.6±0.2 | 0.5±0.2 |
| クリアランス (ミリリットル/(lo×ч)) | 3.9±0.9 | 4.8±1.5 | 3.8±1.5 | 4.1±1.0 | 3.6±1.2 |
* として計算 (とマックス マイナスベースライン第VIII因子) 用量で割る (IU / kg群), ここでCマックス – 第VIII因子の最大レベル, 導入後に決定.
Adveitの安全性と止血効果® 大人の安全性と止血効果と同様の子供たち.
調整された回復率とT1/2 より若い患者の最終段階で 6 何年も経ちました 20% もっと少なく, 成人より, これは、子供の体重1kgあたりの血漿量が多いことによって部分的に説明される可能性があります.
現在、Adveitという薬物の薬物動態のパラメーターに関するデータはありません。® 患者, 以前に未処理.
薬の適応症Adveit®
- 成人およびすべての年齢の子供における出血の治療と予防, 血友病Aの人 (遺伝性第VIII因子欠乏症).
準備のアドバイス® 金額にフォンウィルブランド因子が含まれていない, 薬理効果を達成するために必要, したがって、フォンウィルブランド病の治療には適応されません.
ICD-10コードのオープンリスト
Adveit: 投与計画
薬による治療は、医師の監督の下で開始する必要があります。, 血友病の治療に経験がある, アナフィラキシーの場合に即時蘇生の可能性がある場合.
投与量と治療期間は、第VIII因子欠乏症の程度によって異なります。, 出血の場所と強度, だけでなく、患者の臨床状態. 補充療法の注意深い実験室モニタリングは、大手術や生命を脅かす出血の場合に特に重要です。.
第VIII因子薬の効力は通常、国際単位で表されます。 (自分), WHOの国際基準による. 血漿第VIII因子活性は、パーセンテージで表されます。 (正常なヒト血漿と比較して) または私で (国際規格と比較して).
1つの国際単位 (自分) 第VIII因子活性は、第VIII因子の量に相当します, に含まれています 1 正常ヒト血漿のミリリットル.
治療 “オンデマンド”
第VIII因子の必要用量の計算は、経験的データに基づいています, それに応じて第VIII因子の調製, 投与 1 私と 1 kg体重, 血漿第VIII因子活性を 2 ME / dl.
Adveitの必要な用量® 式によって決定さ:
必要な用量 (自分) =体重 (kg) ×必要 % 第VIII因子の増加× 0.5
出血や臨床状況に, 表に示されている 2 と 3, 第VIII因子活性は、所定のレベルを下回ってはなりません (で表される % 通常の活動からまたはIU/dLで) 関連する期間に. 出血と外科的介入のエピソードのための投与量と投与頻度を選択するとき、あなたはテーブルによって導かれることができます 2 と 3.
テーブル 2. 薬物Adveitの使用® さまざまな種類の出血を伴う
| 出血の程度 | 投与後に必要な第VIII因子活性 (で % 通常またはIU/dl) | 周波数 (時間単位の注射の間隔)/処置時間 (日数で) |
| 関節内出血の最初の兆候, 筋肉への出血または口の出血. | 20-40 | 注射は毎回繰り返されます 12-24 いいえ (すべての 8-24 若い患者の場合はh 6 年) 少なくとも 1 出血の数日前, 痛みがないことから明らかなように, または完全に回復するまで. |
| より顕著な関節内出血, 筋肉や血腫への出血. | 30-60 | 注射は毎回繰り返されます 12-24 いいえ (すべての 8-24 若い患者の場合はh 6 年) 間に 3-4 痛みの緩和と運動活動の回復まで数日以上. |
| 生命を脅かす出血. | 60-100 | 注射は毎回繰り返されます 8-24 いいえ (すべての 6-12 若い患者の場合はh 6 年) 出血が完全に止まり、生命への脅威がなくなるまで. |
テーブル 3. 薬物Adveitの使用® 外科的介入
| 手術の種類 | 投与後に必要な第VIII因子活性 (で % 通常またはIU/dl) | 周波数 (時間単位の注射の間隔)/治療期間 (日数で) |
| 小手術, 抜歯を含む. | 30-60 | すべてを入力してください 24 いいえ (すべての 12-24 若い患者の場合はh 6 年) 以上のための 1 回復までの日数. |
| 主な外科的介入. | 80-100 (手術の前後) | 注射は毎回繰り返されます 8-24 いいえ (すべての 6-24 若い患者の場合はh 6 年) 適切な創傷治癒まで, その後、少なくとも治療を継続します 7 日, からの範囲の第VIII因子活性を維持する 30% へ 60% (ME / dl). |
投与量と投与頻度は、臨床反応に合わせて個別に調整する必要があります。. 特定の状況下で (例えば, 低力価の阻害剤の存在下で) 用量が必要な場合があります, 計算を超える.
治療の過程で、血漿中の凝固第VIII因子のレベルを測定して、次のことを行う必要があります。, 必要に応じて、投与量または投与頻度を調整する.
主要な外科的介入を実施する場合、血漿中の第VIII因子の活性を測定することにより補充療法を監視することが必須です。.
第VIII因子治療に対する臨床反応は患者によって異なる場合があります。, 薬物動態パラメータの異なる値に到達する, 特に, T1/2 とinvivoでの回復率.
出血の予防
重度の血友病Aの患者の出血を長期的に予防するために、投与量は通常、 20 へ 40 からの注射の間隔で体重1kgあたりの第VIII因子ME 2 へ 3 日.
子供の薬の使用
モードで薬を使用する場合 “オンデマンド” Adveitの推奨用量と投与頻度® u 年齢の子ども 0 へ 18 年 同じ, 成人患者のように. 出血の長期予防のために 患者の下で 6 年 の用量で薬を使用することをお勧めします 20 へ 50 体重1kgあたりの第VIII因子ME 3-4 週.
アプリケーションのモード
この薬は静脈内投与のみを目的としています。. 薬が人によって投与される場合, 専門医学教育を受けていない人, 次に、この人はAdveitの管理に関する適切なトレーニングを受ける必要があります®. 薬の投与速度はそう選択されるべきです, 患者に最大限の快適さを提供する. 投与率は超えてはならない 10 ml /分. 推奨されます, 患者の利益のために, 薬を投与するたびに、薬の名前とバッチ番号を書き留めてください.
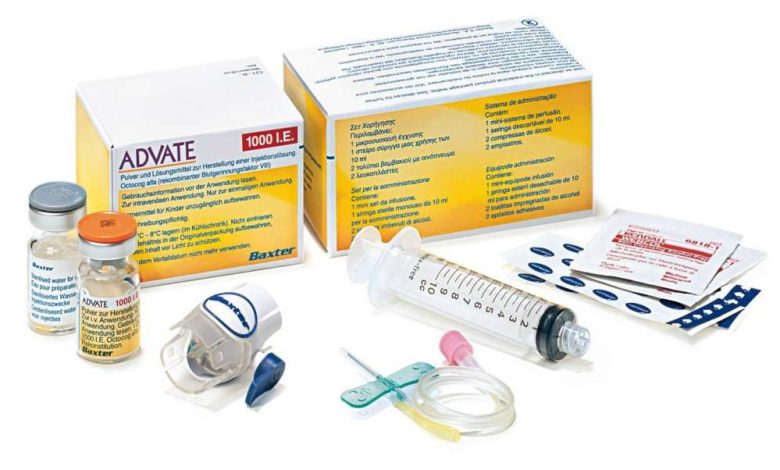
準備のアドバイス® 注射用滅菌水で凍結乾燥物を再構成した後、静脈内投与する必要があります. 再構成されたソリューションは明確である必要があります, 無色で機械的介在物がない. 曇った溶液や溶液を使用しないでください, 目に見える粒子を含む.
- 薬剤を投与するには、ルアーチップ付きの注射器を使用する必要があります。.
- 薬は内で使用する必要があります 3 回復後h.
- 再構成された薬を冷蔵庫に入れないでください.
- 未使用の薬物または残留物は、確立された要件に従って廃棄する必要があります。.
BAXJECTIIデバイスを使用した繁殖
- 無菌のルールに従ってください.
- 薬物を再構成するには、注射および希釈装置に滅菌水のみを使用してください, パッケージに含まれています.
- BAXJECTIIデバイスを使用しないでください, 滅菌バリアシステムまたはパッケージが損傷している場合, または損傷の兆候に気付いた場合.
- 薬が希釈されるまで冷蔵庫に保管されていた場合, Adveitの温度を持ってきてください® (凍結乾燥物) 注射用滅菌水 (溶剤) 室温まで (15°から25°Cまで).
1. 手を洗います, 石鹸とお湯を使う.
2. 凍結乾燥物および溶媒バイアルからキャップを取り外します.
3. アルコールワイプでプラグを拭きます. 平らで清潔な表面にバイアルを置きます.
4. 紙の膜を取り外して、BAXJECTIIデバイスのパッケージを開きます。, パッケージの内容に触れることなく. デバイスをパッケージから取り出さないでください. 使用禁止, BAXJECTIIデバイスの場合, その滅菌バリアシステムまたはパッケージが損傷している.
5. パッケージを裏返し、透明なプラスチックチップを溶媒バイアルのキャップに挿入します. パッケージの端をつかむ, 引き上げてBAXJECTIIデバイスから取り外します. BAXJECTIIデバイスから青いキャップを取り外さないでください.
6. 薬物を希釈するには、注射用の滅菌水のみを使用してください。, パッケージに含まれています. BAKSJECTIIを溶媒バイアルに取り付けることにより, このようにシステムを反転します, 溶剤ボトルがデバイスの上にくるように. 白いプラスチックの先端をAdvateバイアルのストッパーに挿入します。® (凍結乾燥物). 真空のため、溶媒はAdveitを使用してバイアルに流れ込みます。®.
薬剤が完全に溶解するまで、バイアルを静かに回転させます。. チェック, そのアドバイス® (凍結乾燥物) 完全に溶解, そうしないと、活性物質がデバイスのフィルターを通過しません. 薬はすぐに溶けます (通常より少ない 1 M). 再構成されたソリューションは明確である必要があります, 無色で機械的介在物がない.
薬剤の導入
無菌のルールに従ってください.
使用する前に、再構成された薬剤に機械的不純物がないかどうかを確認する必要があります。. 透明で無色の溶液のみを使用してください。.
1. BAXJECTIIデバイスから青いキャップを取り外します. シリンジに空気を吸い込まないでください! シリンジをBACSJECTIIに注入します.
2. システムを裏返します (再構成された溶液の入ったバイアルが上にある必要があります). 再構成された溶液を注射器に吸い込みます, ピストンをゆっくりと引っ込める.
3. シリンジを外します.
バタフライニードルをシリンジに接続します. 溶液は内/内に投与する必要があります, ゆっくり. 薬の投与速度は超えてはいけません 10 ml /分. Adveitの投与前および投与中® 患者の脈拍数を監視する必要があります. 心拍数が大幅に増加します, ほとんどの場合、薬物投与の割合を減らすか、一時的に投与を停止すると、これらの症状をすばやく止めるのに役立ちます.
Adveit: 副作用
Adveitの臨床試験で® 参加した 418 患者, 受信されました, 最低, Adveitの1つの管理®. 登録されました 93 不要な薬物反応 (NLR). 最も頻繁に報告されたADRは次のとおりです。: 阻害剤の出現 (第VIII因子に対する中和抗体), 頭痛と発熱.
過敏症またはアレルギー反応 (これには血管浮腫が含まれる場合があります, 注射部位の灼熱感とかゆみ, 寒気, 赤み, 一般化された蕁麻疹, 頭痛, 限局性蕁麻疹, gipotenziю, 無気力, 吐き気, 不安, taxikardiju, Grudaに狭く, 穿刺, 嘔吐, 喘鳴) まれにしか観察されない, しかし、場合によっては重度のアナフィラキシーに進行しました (アナフィラキシーショックを含みます). 抗マウスおよび/またはハムスタータンパク質抗体および関連する過敏反応が発生する可能性があります.
血友病Aの患者は中和抗体を発症する可能性があります (阻害剤) 第VIII因子. そのような阻害剤の出現は、不十分な臨床反応の形で現れます。. そのような場合はすべて、専門の血友病センターに連絡することをお勧めします.
以下は副作用の頻度に関するデータです, 臨床試験および自発的報告から得られた情報. 副作用は臓器や臓器系の損傷に応じて分類されます; 臓器および臓器系の名前は、MedDRAの用語に従って与えられています.
副作用の発生頻度は、発生頻度に応じたWHONLR分類に従って評価されました。: 多くの場合 (≥1/ 10), 多くの場合 (≥1/100〜 <1/10), まれに (≥1/1000〜 <1/100), まれに (≥1/10,000〜 <1/1000 ), まれに (<1/10000), 未知周波数 (利用可能なデータから確立することはできません). 各周波数グラデーション内で、悪影響は重大度の降順で表示されます。. 頻度は、患者の総数に関連して計算されました, Adveitで処理® (N = 418).
感染症および寄生虫症: まれに – インフルエンザ, laringit.
血液やリンパ系から: 多くの場合 – 第VIII因子阻害剤の出現へ; まれに – limfangit.
免疫システムの一部に: 未知周波数 – アナフィラキシー反応, 過敏症へ.
神経系から: 多くの場合 – 頭痛の種; まれに – 目まい, 記憶障害, 失神, 震え, 片頭痛, disgevziya.
ビジョンの臓器の一部に: まれに – 目の炎症.
心臓血管系: まれに – 動悸, 血腫, ほてり, 蒼白.
呼吸器系: まれに – 呼吸困難.
消化器系の一部: まれに – 下痢, 上腹部の痛み, 吐き気, 嘔吐.
皮膚および皮下組織障害: まれに – かゆみ, 発疹, 多汗症, じんましん.
一般的な障害と注射部位の障害: 多くの場合 – 発熱; まれに – 末梢浮腫, 胸痛, 胸の不快感, 寒気, 幸福の変化, 穿刺部位の血腫; 未知周波数 – 易疲労感, 注射部位での反応, 沈滞.
実験室および機器のデータ: まれに – 凝固第VIII因子のレベルの低下と; 単球の数の増加, ヘマトクリット値の減少, 臨床検査結果の標準からの逸脱.
負傷, 酩酊と操作の合併症: まれに – 術後合併症, 術後出血, 手順のサイトでの反応.
と Advateの持続注入中に、1人の患者で第VIII因子レベルの予期しない減少が発生しました。® オン 10-14 手術後の日数. この期間中、止血は維持された. 血漿第VIII因子レベルとクリアランスは術後15日目までに正常に戻った. 第VIII因子阻害剤試験, 連続注入の終わりと研究の終わりに実行されます, 否定的な結果をもたらした.
へ この副作用に関する情報を以下に示します。.
個々の副作用の説明
第VIII因子阻害剤の出現
Adveitの免疫原性® を含む臨床試験で研究されています 233 患者 (子供と大人) 重度の血友病A (第VIII因子レベル≤1%) 以前に第VIII因子濃縮物で治療された (少なくとも 150 成人および6歳以上の小児における投与日数 50 未満の子供の投与日数 6 年). 後の1人の患者 26 Adveitの投与日数® 低力価で阻害剤の出現を観察した (2.4 ベセスダユニット [WAS] 修正されたベセスダテストに基づく). 研究への患者の参加が終了した後、阻害剤は検出されませんでした。.
Advateの使用期間の中央値® すべての臨床試験で以前に治療を受けた患者では、 97 日 (からスイープ 1 へ 709 紹介の日). 阻害剤の全体的な発生頻度 (高い, と低力価) 製 0.4% (u 1 から 233 患者).
完了した管理されていない臨床試験 060103, u 16 から 45 (35.6%) 重度の血友病Aの未治療の患者 (第VIII因子レベル≤1%), Adveitを受け取った人® 少なくとも 25 申請日数, 開発された第VIII因子阻害剤. で 7 (15.6%) 患者は阻害剤の力価が高く、 9 (20%) 患者 – 阻害剤の力価が低い (1人の患者を含む, 阻害剤の発症は一過性として分類されました).
この研究における阻害剤の開発の危険因子は次のとおりです。: 非白人の民族性, 第VIII因子阻害剤の家族歴および高用量のAdvateによる集中治療® 最初 20 紹介の日. で 20 患者, 記載されている危険因子を持っていなかった人, 阻害剤の出現は認められなかった.
免疫寛容の誘導に関するデータが得られた (IIT) 以前に治療を受けていない患者では, 患者, その中で、薬物Adveitを使用するとき® 第VIII因子阻害剤が同定されている. 研究内のサブスタディ中 060103 患者と, 以前に未処理, IIT治療はで文書化されています 11 患者, 以前に未処理. で 30 IITの患者 (調査 060703) 医療記録の遡及的分析が実施された. IIT患者レジストリのデータ収集は進行中です.
研究で 060201 長期予防的治療の2つのレジメンの比較分析が 53 患者, 以前に扱われた (RLP): 投薬スケジュール, 個々の薬物動態パラメータに基づいて選択 (からの範囲内 20 へ 80 ME第VIII因子 1 間隔でkg体重 72 ± 6 営業時間; N = 23), および標準的な予防的投薬レジメン (から 20 へ 40 IU/kgごと 48 ± 6 いいえ; n = 30). 投薬計画の目的, 個々の薬物動態パラメータに基づいて選択 (特別な式で計算されます), 注射間の72時間間隔で第VIII因子の最小レベルを1%以上に維持することでした. この研究からのデータは証明します, 両方の予防的投薬レジメンは、出血率の低下に関して同等であるということ.
有害反応, 関連物質, 製造工程で使用
から 229 患者, Adveitで治療を受けた人® チャイニーズハムスター卵巣細胞タンパク質に対する抗体の存在を調べました (SNO), u 3 患者は抗体価の統計的に有意な増加を示した, u 4 患者は抗体価の持続的なピークまたは一過性の上昇を示した, そしてある患者では、, およびその他. 抗体価のこれらすべての変化は、臨床症状を伴わなかった。.
これらの 229 治療を受けた患者, Adveitで治療を受けた人® マウス免疫グロブリンGに対する抗体を調べました (のIgG), u 10 患者は抗体価の統計的に有意な増加を示した, u 2 患者、抗体価の安定したピークまたは一過性の上昇が検出され、1人の患者ではその後, およびその他. これらの患者のうちの4人, 蕁麻疹の孤立した症例が報告されています, そう痒, 発疹, 好酸球の数のわずかな増加 (示されたすべての患者に、薬物Advate® 繰り返し注入).
過敏症
アレルギータイプの反応にはアナフィラキシーが含まれ、めまいとして現れました, paresteziej, 発疹, 潮, 顔の腫れ, じんましんとかゆみ.
子供の薬の使用
以前に治療を受けていない患者における阻害剤の形成とカテーテル関連の合併症を除いて, 副作用の頻度に差はありません, すべての年齢の患者で, 臨床試験で特定されていません.
疑わしい有害反応の報告
疑わしい副作用に関する情報により、Adveitという薬のベネフィット/リスク比を常に監視できます。®. 医者, 薬物Adveitを使用して® 血友病Aの患者の治療のため, 疑わしい副作用を報告する必要があります, 医薬品の登録証明書発行後の期間に開発された, 標準的な手順に従って、国内のファーマコビジランス当局に.
Adveit: 使用の禁忌
- 活性物質またはいずれかの賦形剤に対する既知の過敏症, マウス/ハムスタータンパク質と同様に.
Adveit: 妊娠中および授乳中の使用
薬物の影響Adveit® 動物の生殖機能については研究されていません. なぜなら, その血友病Aは女性では非常にまれです, 薬の安全性Adveit® 妊娠中の女性と授乳中の女性は確立されていません. Adveitを処方する前に® 妊娠中および授乳中、医師は個々の患者の潜在的なリスクと期待される利益を慎重に比較検討する必要があります.
Adveit: 特別な指示
過敏性反応
たんぱく質製剤の導入により、アレルギー反応の発症が可能になります。. 準備のアドバイス® たんぱく質です, また、微量のマウスとハムスターのタンパク質が含まれています.
薬物Advateを使用する場合® アレルギー型過敏反応が報告されています, アナフィラキシーを含みます. 患者は、即時の過敏反応の初期の兆候を知らされるべきです。, じんましんなど, かゆみ, 一般的な水疱性発疹, 血管神経性浮腫, 低血圧 (めまいや失神を伴う), ショックと急性呼吸窮迫 (胸の圧迫感, 喘鳴). これらの症状が発生した場合は、すぐに薬の使用を中止し、医師に連絡するように患者に通知する必要があります。. 感電した場合は、一般的に認められている感電対策を講じる必要があります。.
第VIII因子阻害剤の形成
第VIII因子に対する中和抗体の出現 (阻害剤) 血友病Aの患者の治療における既知の合併症です, これは、第VIII因子薬の凝固促進活性の低下によって臨床的に明らかになります. 阻害剤はクラスG免疫グロブリンです. 阻害剤の力価はベセスダ単位で測定されます。 (WAS) 修正ベセスダ法を使用した血漿1mlあたり.
第VIII因子阻害剤の出現により、患者はAdvateに対する不十分な臨床反応を経験する可能性があります。®. この場合、専門の血友病治療センターに連絡することをお勧めします。. 阻害剤を開発するリスクは、第VIII因子薬の使用期間と相関関係があります。 (リスクは最初の間に最も高くなります 20 紹介の日), だけでなく、遺伝的および環境的要因. まれに、阻害剤が最初の後に現れることがあります 100 紹介の日.
阻害剤の再形成の事例があります (低力価で) 以前に治療を受けた患者では, 阻害剤の歴史を持つ, (以上の治療 100 紹介の日) 患者をある第VIII因子薬から別の薬に切り替えた後. したがって、ある第VIII因子薬による治療から別の治療に切り替えた後は、継続的なモニタリングを実施する必要があります。 (臨床として, 実験室だけでなく) 患者のために, 第VIII因子薬で治療, 阻害剤の早期発見のため.
一般に, 患者のために, 凝固第VIII因子薬で治療, 適切な臨床観察と臨床検査を通じて、阻害剤の発生を注意深く監視する必要があります. 第VIII因子血漿活性の期待されるレベルが達成されない場合, または適切な用量で出血を制御できない場合, 第VIII因子阻害剤を検出するには、適切なアッセイを実施する必要があります. 高レベルの第VIII因子阻害剤を使用している患者では治療が効果的でない場合があります, 代替療法の使用を検討する必要があります. これらの患者は医師によって治療されるべきです。, 第VIII因子阻害剤の存在下での血友病の治療経験.
Adveitによる予防療法® 個別の用量選択で
投与間隔でベースライン第VIII因子レベルを1%以上に維持するため, 成分 72 いいえ, Advateの単回投与® 個々の薬物動態パラメータの値を考慮して、医師が個別に選択することができます. 臨床試験では、それが示されました, その予防的投薬レジメン 20-40 48±6時間ごとのIU/kgは、レジメンと同様の臨床効果を示します 20-80 ME / kg、72±6時間間隔, オンデマンド治療と比較して、予防的治療により出血率が大幅に低下します.
1日おきに薬剤を投与する標準的な予防レジメンと、薬物動態パラメータに応じて用量を選択し、3日おきに薬剤を投与する個別の予防的治療のレジメンは、同等の有効性を有する。.
治療中のカテーテル関連の合併症
中心静脈アクセスデバイスが必要な場合, その後、カテーテル関連の合併症を発症するリスクがあります, 局所感染など, 菌血症, カテーテル部位の血栓症.
情報, 添加剤に関して
再構成後、薬液には 0.45 ミリモルナトリウム (10 ミリグラム) バイアルあたり. 患者に薬剤を投与するときに考慮されるべきです, ナトリウムの制限ダイエットに位置.
小児科での使用
記載されている特別な警告および注意事項は子供に適用されます。, 同程度に, 大人も.
保管および使用に関する特別な指示
微生物汚染の可能性を排除するため, 薬は、溶液の調製後すぐに投与する必要があります. しかし、それは証明されています, Adveitの準備されたソリューション® 時間の経過とともに化学的および物理的に安定 3 25°Cでh.
有効期限内に、薬は室温で保存することができます (25 ° c よりも高い) これ以上の内 6 ヶ月. 室温での薬剤の保管の開始日と終了日は、薬剤のパッケージに記録する必要があります。. 室温で保管した後は、冷蔵庫に保管するために薬剤を置かないでください。.
Adveitの各管理で推奨® 患者と薬のバッチの間のリンクを確立できるように、薬の名前とバッチ番号を医療記録に記録します.
車両とメカニズムを運転する能力への影響
準備のアドバイス® 車両を運転する能力やメカニズムを操作する能力には影響しません.
Adveit: 過剰摂取
組換え血液凝固第VIII因子製剤の過剰摂取の症例は報告されていません。. 過剰摂取の症状が知られています。.
Adveit: 薬物相互作用
Adveit®と他の医薬品との相互作用の研究は行われていません。.
Adveit: Adveit®の保管条件
薬は、光から保護するために段ボール箱に保管する必要があります。, 2°から8°Cの温度で子供がアクセスできない場所で; 凍結しないでください.
Adveit: Adveit®の貯蔵寿命
貯蔵寿命 – 2 年. 有効期限を超えて使用しないでください.
Adveit: 実施条件
薬物は、処方の下でリリースされて.
