Il meccanismo di azione dei farmaci
Nella stragrande maggioranza dei casi, in modo che la sostanza medicinale (ligando) ha avuto il suo effetto, deve incontrare componenti specifici nel corpo: recettori bersaglio, strutture molecolari, rappresentare sono proteine, meno comunemente acidi nucleici, lipidi o altre configurazioni, situati all'interno o sulla superficie delle cellule, с которыми оно взаимодействует, avviando una catena di processi biochimici e fisico-chimici, portando ad un certo effetto.
Esistono due tipi di recettori di membrana: canali ionici e recettori, Accoppiato con proteine G. Per Esempio, L'adetilcolina e farmaci simili sono caratterizzati da un canale del sodio. L'acetilcolina interagisce con la proteina canale, causando cambiamenti conformazionali in esso, che favoriscono l'apertura del canale e la penetrazione degli ioni sodio nella cellula. Questo processo è alla base dell'eccitazione nervosa. Alcuni farmaci, interagendo con la proteina canale del sodio, impedirne l'apertura, bloccando così la trasmissione dell'eccitazione nervosa.
Una cosiddetta proteina G si attacca all'interno della membrana plasmatica delle cellule., che garantisce la sincronizzazione del processo di interazione farmacologica con l'attivazione simultanea delle corrispondenti proteine bersaglio intracellulari. Come mostra l'immagine, la molecola del farmaco interagisce con il recettore (P) sulla superficie esterna della membrana, che provoca cambiamenti conformazionali nella proteina recettore. A causa di ciò, la proteina G cambia la sua struttura spaziale, migra nel piano della membrana verso gli enzimi, che sono in uno stato inattivo all'interno della cellula. Interazione della proteina G con gli enzimi (T) provoca la loro attivazione (LV/R/T). Noradrenalina, la dopamina e altri ligandi interagiscono specificamente con i recettori, Accoppiato con proteine G. Dovrebbe essere notato, che l'acetilcolina può interagire non solo con la proteina canale, ma anche con i recettori, Accoppiato con proteine G.
Affinché avvenga l'interazione tra un ligando e un biorecettore, è necessaria, in modo che abbiano complementarità, cioè deve esserci una certa affinità tra loro, o affinità (corrispondenza delle dimensioni, configurazione spaziale, la presenza di cariche opposte, ecc.. d.). Per Esempio, la carica positiva del ligando esogeno deve corrispondere alla carica negativa del recettore, e i radicali non polari della sostanza possono legarsi alle regioni idrofobiche del recettore.
Tra le proprietà fisico-chimiche delle sostanze medicinali, influenzando la loro interazione con i recettori, la dimensione della molecola dovrebbe essere evidenziata, a seconda di quale la sostanza può interagire con l'intero recettore o con un suo componente. La cinetica della sua penetrazione attraverso le membrane biologiche dipende anche dalla dimensione della molecola del farmaco.. Tipicamente, all’aumentare delle dimensioni di una molecola, aumentano la sua flessibilità e la possibilità di formare legami di van der Waals con un partner macromolecolare.. Inoltre, La stereochimica della molecola del farmaco è importante. Da, In quale forma isomerica si trova il farmaco?, dipende dalla sua attività farmacologica. E devi tenerlo a mente: tanto più rigida è la conformazione della molecola recettore, maggiore è la differenza nell'effetto degli stereoisomeri.
L'interazione farmaco-recettore avviene attraverso legami intermolecolari. Inizialmente, la sostanza viene attratta dal recettore mediante forze elettrostatiche, e in presenza di complementarità forma legami con il recettore utilizzando interazioni fisiche e fisico-chimiche (tipico delle sostanze medicinali, che vengono escreti dal corpo invariati o poco modificati) o interazioni chimiche (inerenti alle connessioni, che subiscono trasformazioni chimiche nel corpo). Le forze di van der Waals più deboli prendono parte alla determinazione della specificità dell'interazione di un farmaco con i sistemi reattivi biochimici. I legami idrogeno sono coinvolti nei processi di riconoscimento e fissazione delle sostanze (del ligando) alle biostrutture. I legami ionici si verificano quando, quando le sostanze medicinali contengono un gruppo cationico o anionico, e le strutture opposte si trovano nei biorecettori. I legami ionici si formano spesso nelle prime fasi di una reazione farmacologica tra sostanze e recettori. In questi casi, l’effetto del farmaco è reversibile. La formazione di legami covalenti di coordinazione è importante. Con la loro partecipazione si verificano interazioni di agenti alchilanti con biosubstrati, così come farmaci e antidoti con metalli nella formazione di complessi chelati stabili, ad esempio,, unitiolo con arsenico o tetacina-calcio con piombo. L'effetto di tali sostanze è irreversibile.
Inoltre, c'è un'interazione idrofobica. Sebbene l'energia dei suoi legami sia piccola, l'interazione di un gran numero di lunghe catene alifatiche porta all'emergere di sistemi stabili. Le interazioni idrofobiche svolgono un ruolo nella stabilizzazione delle conformazioni dei biopolimeri e nella formazione delle membrane biologiche.
I residui di amminoacidi in una molecola di recettore proteico contengono gruppi polari e non polari, che determinano la formazione di legami polari e apolari tra loro e le sostanze medicinali. Gruppi polari (-OH, -NH, COO-, -N3H, =O) fornire istruzione, principalmente, legami ionici e idrogeno. Gruppi non polari (idrogeno, metile, radicali ciclici, ecc.) formano legami idrofobici con farmaci a basso peso molecolare.
Quindi, l'interazione dei farmaci con recettori specifici può essere effettuata a causa di vari legami chimici, avere una forza disuguale. Così, forza approssimativa di sostanze simili al curaro con recettori colinergici per l'elettrostatica (ionico) l'interazione equivale a 5 kcal/mol, dipolo ionico - 2-5 kcal/mol, dipolo-dipolo - 1-3 kcal/mol, legami idrogeno - 2-5 kcal/mol, Collegamenti di van der Waals - 0,5 kcal/mol, legami idrofobici - 0,7 kcal per CH2-gruppo. La diminuzione della forza di legame in funzione della distanza tra gli atomi per l'interazione elettrostatica è r-2, dipolo ionico - r-3, dipolo-dipolo - r-4, legami idrogeno - r-4, Obbligazioni di van der Waals - r-7. Questi tipi di connessioni possono essere interrotti, che garantisce la reversibilità dell’azione dei farmaci. I legami covalenti sono più forti, che forniscono effetti a lungo termine e spesso irreversibili delle sostanze, ad esempio,, farmaci antitumorali alchilanti. La maggior parte dei farmaci si legano ai recettori in modo reversibile. Dove, generalmente, la natura della connessione è molto complessa: può coinvolgere contemporaneamente lo ionico, dipolo-dipolo, van der Waals, legami idrofobici e altri tipi di legami, che è in gran parte determinato dalla complementarità della sostanza e del recettore e, rispettivamente, il grado della loro vicinanza reciproca.
La forza del legame di una sostanza ai recettori viene definita “affinità”. Sostanze, agendo sugli stessi recettori, possono avere diversi gradi di affinità con loro. In questo caso, le sostanze con maggiore affinità possono spostare le sostanze con minore affinità dal connettersi con i recettori. Determinare lo stato di equilibrio tra i recettori “occupati”. (DR), recettori liberi e sostanza libera (D) viene utilizzata la costante di dissociazione (KD), che è determinato dalla seguente formula:
KD=[D]*[R]/[ DR]
Logaritmo negativo di KD (PRD) è un indicatore di affinità. L'indicatore pD viene spesso utilizzato per caratterizzare l'affinità2, t. è. logaritmo negativo di EC50, (concentrazione della sostanza, in cui produce un effetto, componente 50% dal massimo effetto).
Varietà di legami di interazione chimica e loro forza disuguale, oppure l'affinità tra ligandi e biorecettori è spiegata dalla complessa struttura dei farmaci, contenente radicali di diversa reattività e avente forma volumetrica multidimensionale, così come la complessità dei processi di interazione, spesso avviene in più fasi (fasi): formazione di un complesso farmaco-recettore; raggruppamento intramolecolare; dissociazione del complesso.
Quindi, un effetto farmacologico può essere causato solo da sostanze con un'affinità pronunciata per il biorecettore. La gravità dell'effetto dipende dalla concentrazione della sostanza farmacologica e dal numero totale di recettori.
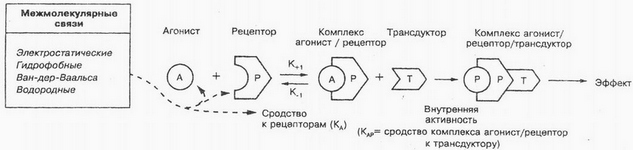
Se le sostanze hanno un'attività interna sufficiente, allora vengono chiamati agonisti. L'attività intrinseca si riferisce alla capacità degli agonisti di provocare un effetto biologico modificando la conformazione dei recettori, t. è. capacità di un ligando di attivare un recettore. Questo fenomeno è considerato come l'affinità del complesso agonista-recettore per il trasduttore, la trasformazione dei segnali esterni in interni è detta trasduzione. La trasmissione del segnale intracellulare è alla base di tali processi, come la contrazione delle fibre muscolari, divisione cellulare, proliferazione, differenziazione, ecc.. E 'ormai accertato, che dire di molte sostanze? (ormoni, peptidi bioattivi, Nucleotidam, steroidi, bioregolatori a basso peso molecolare, ecc.) la cellula ha recettori specifici. Come risultato dell'interazione di queste sostanze con questi recettori specifici, si formano messaggeri secondari (intermediari), che innescano una cascata di reazioni biochimiche.
Esiste un concetto"agonisti parziali» - sostanze medicinali, che, legame ai recettori, non danno il massimo effetto. Questo fenomeno sconcertante è presumibilmente spiegato da incompleto (a) dipendenza dell'affinità del complesso farmaco-recettore dal trasduttore. Per Esempio, l'agonista parziale del recettore degli oppiacei nalorfina agisce in modo simile alla morfina, l'agonista completo del recettore degli oppiacei, anche se più debole dell'ultimo. Allo stesso tempo, se usate insieme, la nalorfina indebolisce o elimina gli effetti della morfina; in particolare, l'effetto inibitorio della morfina sulla respirazione viene eliminato. L'isoprenalina è un vero agonista, e il prenalterolo è un agonista parziale dei recettori β-adrenergici. Secondo la teoria del recettore, un vero agonista può indurre una risposta massima, anche se interagisce solo con una parte dei recettori.
Recettori specifici possono avere siti di legame uguali o diversi per agonisti e antagonisti. Possibili diversi siti di legame per diversi agonisti. In quel caso, quando l'agonista e l'antagonista hanno gli stessi siti di legame e l'effetto bloccante dell'antagonista sul recettore viene completamente eliminato aumentando la concentrazione dell'agonista (si ottiene il massimo effetto agonista), la relazione tra antagonista e agonista viene definita antagonismo competitivo. Se i siti di legame per l'agonista e l'antagonista sono diversi, allora il rapporto tra loro viene definito antagonismo non competitivo. L'indicatore pA viene spesso utilizzato per caratterizzare gli antagonisti2 (logaritmo negativo della concentrazione molare dell'antagonista, in cui per ottenere l'effetto standard dell'agonista è necessario raddoppiarne la concentrazione).
Nelle condizioni dell'intero organismo, agonisti e antagonisti causano cambiamenti in alcune funzioni fisiologiche. L'azione degli antagonisti in questo caso è determinata da, che interferiscono con l'influenza dei corrispondenti ligandi naturali su recettori specifici (ad esempio,, l'atropina, antagonista del recettore M-colinergico, interferisce con l'azione del loro agonista acetilcolina). Cambiamenti, che sono direttamente correlati all'interazione delle sostanze con recettori specifici, indicato con il termine “reazione farmacologica primaria”., che potrebbe essere l’inizio di tutta una serie di reazioni, portando alla stimolazione o all’inibizione di alcune funzioni fisiologiche”.
Cambiamenti nelle funzioni di organi o sistemi (ad esempio,, cambiamenti nella forza e nella frequenza delle contrazioni cardiache, tono della muscolatura liscia degli organi interni, secrezioni ghiandolari, BP e altri.), indotto dai farmaci, indicato come effetti farmacologici di questa sostanza. Così, per i glicosidi cardiaci, la reazione farmacologica primaria è l'inibizione dell'attività di trasporto del Na+, K-ATF-o fibra miocardica, che è considerato un possibile recettore specifico per i glicosidi cardiaci. A questo proposito, l’ingresso del K+ nelle fibre muscolari e l’uscita del Na+ dalle fibre vengono interrotti., Il contenuto di Ca2+ nel citoplasma aumenta, che promuove l'interazione tra actina e miosina. Il risultato di questi cambiamenti è un aumento della forza delle contrazioni cardiache, qual è il principale effetto farmacologico dei glicosidi cardiaci.
Gli effetti a lungo termine degli agonisti su recettori specifici sono spesso accompagnati da una diminuzione della loro sensibilità. Quest'ultimo può essere associato a cambiamenti nei recettori, riducendone il numero (densità) o interruzione dei processi, che seguono la stimolazione dei recettori. Allo stesso tempo, gli effetti farmacologici degli agonisti diventano meno pronunciati.
Quindi, gli effetti farmacologici della maggior parte dei farmaci sono associati al loro effetto sui corrispondenti recettori specifici.
Le sostanze con elevata affinità per il biorecettore e bassa attività interna sono chiamate antagonisti, o bloccanti, poiché loro, senza causare cambiamenti nella conformazione dei biorecettori, prevenire l'interazione di ligandi agonisti endogeni e/o esogeni con esso. Esistono anche i cosiddetti “recettori secondari o silenti”, a cui si legano i farmaci, ma non hanno alcun effetto farmacologico. Tali recettori “silenziosi” sono spesso presenti nelle proteine e nel plasma sanguigno (ma si possono trovare anche nei tessuti). La connessione con i recettori “silenziosi” porta ad una diminuzione della concentrazione della sostanza farmacologica libera, e quindi ad una diminuzione dell'effetto terapeutico.
Numerose teorie moderne, spiegare il meccanismo di interazione ligando-recettore, stato dei recettori stessi, mancanza di proporzionalità tra il numero di recettori occupati e la reazione finale, cambiamenti nell'efficienza della trasmissione del segnale e esistenza di recettori di riserva e agonisti parziali, ecc.. d. ha costituito la base per idee sul meccanismo d'azione dei rappresentanti di vari gruppi di sostanze medicinali. Queste interazioni sono suddivise in interazioni recettoriali e interazioni chimiche.
Meccanismo d'interazione dei farmaci con i biorecettori può essere rappresentato come il seguente diagramma: ciascun ligando (farmaco o substrato fisiologico) si lega a un sito specifico su un recettore specifico. I recettori attivati regolano direttamente o indirettamente i flussi di ioni (1) e/o altri processi intracellulari (secrezione o contrazione muscolare) o attiva il sistema proteico legante il nucleotide della guanina (proteine G), cosa, a sua volta, migliora l'attivazione del sistema enzimatico del secondo messaggero. Nel citoplasma funzionano diversi secondi messaggeri, attivando varie proteine bersaglio, ad esempio proteine- chinasi. Questi ultimi agiscono su substrati specifici e mediano l'effetto farmacologico.
Dalla descrizione presentata è chiaro, che l'azione delle sostanze medicinali avviene attraverso i seguenti meccanismi:
- funzioni fisiologiche dei tessuti (ad esempio,, contrattile, secretivo) può essere regolato da più recettori, e quindi, e vari ligandi;
- Possono esserci diversi passaggi intermedi tra l’interazione farmaco-recettore e la risposta del tessuto o dell’organo, in particolare l'attivazione dei sistemi di secondo messaggero associati ai recettori;
- efficienza dei meccanismi, responsabile della sequenza stimolo-risposta, e la densità del recettore può variare da tessuto a tessuto.
L'effetto terapeutico di alcune sostanze medicinali è dovuto alla loro azione diretta (non associato a recettori specifici) interazione chimica con composti endogeni o altri meccanismi di interazione (osmolalità, adsorbimento). Quindi per i diuretici osmotici - mannitolo, urea: non ci sono recettori specifici. Queste sostanze aumentano la pressione osmotica nei tubuli renali, di conseguenza, il riassorbimento dell'acqua è compromesso e la diuresi aumenta. L'azione delle sostanze adsorbenti non è associata a recettori specifici, diuretici acidogeni.
Antiacidi (ad esempio,, idrossidi di alluminio o magnesio) reagiscono con l'acido cloridrico per formare prodotti con proprietà debolmente acide. Agenti chelanti, legame con alcuni metalli, formare complessi chimici inattivi.
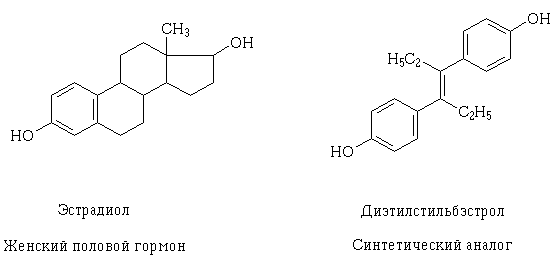
Con l'approfondimento delle conoscenze sulla struttura dei recettori e sul meccanismo della possibile interazione farmacodinamica dei farmaci a livello cellulare, la loro creazione mirata è diventata possibile, così come una spiegazione, Perché le sostanze medicinali possono avere effetti simili?, diverso, a prima vista, la sua struttura. Un esempio di questo fenomeno è l'estradiolo e l'isomero trans del dietilstilbestrolo, un analogo sintetico dell'ormone sessuale femminile.. Le loro molecole strutturali sono diverse, ma contengono gruppi idrossilici funzionali di proprietà e dimensioni identiche, simili localizzati e orientati nello spazio, per cui le molecole di queste sostanze possono interagire con lo stesso recettore ed avere effetti farmacologici simili.
Metodi, mediante il quale le sostanze medicinali provocano determinati effetti farmacologici, indicato con il termine “meccanismi d’azione”. Questo concetto viene utilizzato per spiegare l'azione dei farmaci sul piano molecolare, livelli di organi e sistemi. Per Esempio, Il meccanismo d'azione dei farmaci anticolinesterasici a livello molecolare si riduce al blocco dell'acetilcolinesterasi attraverso l'interazione con i suoi centri anionici ed esterasi. Contemporaneamente, spiegare il meccanismo dell'azione ipotensiva dei farmaci anticolinesterasici, indicano bradicardia e vasodilatazione come causa di questo effetto, t. è. considerare il meccanismo di questo effetto a livello di organo.
La ricerca sui meccanismi d'azione delle sostanze medicinali è in corso, Inoltre, le idee sul meccanismo d'azione di una particolare sostanza medicinale non solo possono diventare più dettagliate man mano che si ottengono nuovi dati, ma cambiano anche in modo significativo.
