Studi tentang hemostasis pembuluh darah-platelet
Pelanggaran pada tingkat hemostasis dapat terjadi dengan kecenderungan untuk perdarahan atau trombosis, tergantung pada metode penelitian yang dipilih. Selain, Semua metode penelitian platelet Hemostasis dibagi menjadi primer dan sekunder, Tes atau baris kedua, yang hanya berlaku dalam kasus, jika menggunakan tes mengungkapkan pelanggaran. Utama (bazïsnım) Berikut ini adalah tes.
Sampel untuk ketahanan (kerapuhan) kapiler - manset, Guci, angiorezistometriya
Dari tes ini, paling mudah diakses dan belum cukup informatif Contoh Konchalovsky-Tiller-LEED.
Estimasi yang dibuat pada jumlah dan ukuran perdarahan, terbentuk di atas permukaan palmar lengan bawah (dalam lingkaran dengan diameter 5 cm) Setelah 5 menit kompresi pada tekanan manset bahu 12-13,3 kPa (90-100 Mm Hg. Seni.). Hasil diperhitungkan melalui 5 menit setelah penghapusan manset. Jumlah petechiae lebih 10 menunjuk ke peningkatan kerapuhan microvessels, yang sering dikaitkan dengan trombositopenia atau fungsi trombosit pelanggaran angiotroficheskoy. Juga memperhitungkan terjadinya perdarahan, dan tepat di bawah kerah.
Sampel Banochnaya dilakukan di daerah yang sama dari kulit pada tekanan negatif membangun di tingkatan - dari 20 kPa (150 mm Hg. Seni.) dan lebih rendah. Dalam menilai petechiae hasil dihitung, muncul di Bank.
Sampel pada durasi dan besarnya perdarahan kapiler
Dalam klasik Duke sidang daun telinga rol lebih rendah setelah pemanasan cahayanya menembus ke kedalaman 3,5-4 mm. Pendarahan dalam penelitian ini biasanya tidak melebihi 4 m, setetes darah di kertas filter yang relatif rendah dan mulai menurun dengan cepat sejak sekitar 1-1,5 menit setelah tusukan. Ketika menyatakan trombositopenia (kurang 20 T di 1 l) disfungsi trombosit dan waktu perdarahan berat meningkat menjadi 20-40 menit, noda darah yang jauh lebih besar, dan penurunan jangka panjang atau mengurangi gelombang, kemudian meningkat lagi. Sampel Duke tidak cukup sensitif, di 2/3 Pasien dengan thrombocytopathies memberikan hasil yang normal.
Tes lebih sensitif, di mana waktu pendarahan diselidiki pada latar belakang sebuah stasis vena artifisial diciptakan, yang bahu ditumpangkan pada aparat manset untuk mengukur tekanan darah dan untuk penelitian didukung tekanan, sama 5,3 kPa (40 mm Hg. Seni.). Terhadap latar belakang stasis seperti di Borchgrevink sampel-Vaaler pada permukaan palmar dari ketiga atas dari lancet lengan diterapkan kedalaman sayatan melintang 1 mm dan panjang 8-10 mm (laju waktu perdarahan - up 10 m), dan sampel Ivey et al. sama diterapkan pada lancet lengan untuk mengambil darah dari tusukan jari tiga mendalam melintang 3 mm (laju waktu perdarahan - up 7 m).
Terhadap latar belakang stasis vena yang sama dilakukan Sebuah studi di. DARI. Shitikova, dimana di falang terminal diterapkan kedalaman tusukan 3 mm, kemudian ujung jari dicelupkan ke dalam cangkir 5 ml larutan natrium klorida isotonik dan waktu perdarahan dihitung dalam cahaya yang ditransmisikan (Jika solusi tersebut secara intensif bernoda darah, tindak lanjut untuk jari tersebut akan dipindahkan ke secangkir berbeda). Jumlah darah yang hilang ditentukan oleh peningkatan volume cairan dalam cangkir (laju waktu perdarahan - up 4 m, volume darah yang hilang - dari 0,01 untuk 0,4 ml).
Dalam tes di T. N. Shushkevich Volume darah yang hilang ditentukan oleh warna amonia (0,04 %) , yang direndam kertas dengan noda darah, dengan kolorimetri pada colorimeter medis.
Indikasi tes selama perdarahan, Abnormal, bukti penyalahgunaan menyatakan hemostasis platelet-vaskular, Namun, di bawah hasil normal sampel ini tidak mengecualikan thrombocytopathy menyatakan ringan.
Menghitung jumlah trombosit darah
Menghitung jumlah trombosit darah (di ruang penghitungan bawah Goryaeva fase kontras atau warna, atau dengan bantuan counter partikel) - Cara yang paling penting untuk mendiagnosis trombositopenia dan thrombocytopathy, melanjutkan dengan penurunan terus menerus atau intermiten dalam jumlah sel-sel ini (anomali Bernard-Soulier, Mea—Heggglina dkk.).
Jumlah trombosit juga menunjukkan, Apakah penelitian fungsional lebih lanjut dapat dilakukan dan dengan cara apa sebaiknya dilakukan? (dengan atau tanpa prakonsentrasi trombosit, secara fotometrik atau mikroskopis, dll.. d.).
Mempelajari ukuran trombosit pada apusan – trombotsitometriya
Mempelajari ukuran trombosit pada apusan (trombotsitometriya) memungkinkan Anda membuat penilaian awal tentang berbagai populasi sel-sel ini dalam darah subjek dan memperoleh informasi tentang sejumlah anomalinya, serta saturasi trombosit dengan butiran.
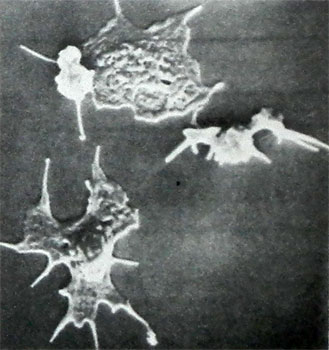
Untuk beberapa trombositopati (Sindrom Wiskott-Aldrich) trombosit yang sangat kecil mendominasi dalam darah (untuk 2 diameternya µm), dengan yang lain - bentuk raksasa (anomali Bernard-Soulier, Meya—Hegglina) - Untuk 8 m atau lebih. Pada sejumlah trombositopati, sel-sel ini miskin granula (cm. di bawah), di negara lain, sentralisasi butiran terganggu ketika trombosit menyebar di kaca, yang menunjukkan adanya pelanggaran reaksi pelepasan butiran dan zat yang dikandungnya, diperlukan untuk hemostasis. Semua properti ini, serta kemampuan trombosit untuk menyebar dan membentuk proses, penilaian struktur sel-sel ini dapat dipelajari dengan menggunakan mikroskop elektron konvensional dan pemindaian, dan juga menggunakan optik interferensi menurut Nomarski.
Retraksi bekuan darah secara alami dilanggar dengan trombositopenia parah (kurang dari 30-40 G masuk 1 l) dan dalam beberapa bentuk defisiensi trombosit kualitatif, paling sering - dengan trombositoastia Glanzmann, trombositopenia uremik, dll.
Studi tentang fungsi agregasi perekat trombosit (AAFT)
Studi tentang fungsi agregasi perekat trombosit (AAFT) - mata rantai terpenting dalam diagnosis laboratorium sebagian besar trombositopati. Saat ini, sejumlah metode penelitian yang mudah dilaksanakan dan tersedia untuk umum telah dikembangkan., termasuk visual, mikroskopis dan perangkat keras (agregatometer, mikrofilter, dll.) pendaftaran fungsi ini, metode berikut dapat dianggap sebagai indikasi:.
Metode retensi trombosit pada kaca (atau filter)
Trombosit dihitung dalam darah vena sebelum dan sesudah melewatinya dengan kecepatan tertentu melalui kolom manik kaca standar atau melalui kuncir fiberglass.; Berdasarkan hilangnya trombosit dari darah, tingkat kelengketannya dinilai.
Lebih mudah diakses, meskipun agak kurang akurat, suatu metode untuk menentukan jumlah trombosit dalam darah sebelum dan sesudah kontaknya selama jangka waktu tertentu dengan permukaan bagian dalam labu, berputar dengan kecepatan tertentu. Metode yang lebih akurat untuk menentukan retensi trombosit pada filter millipore (diameter pori - 15-20 mikron). Dalam pengujian ini, evaluasi dapat dilakukan dengan meningkatkan gradien tekanan di atas dan di bawah filter (penyumbatan pori-pori oleh trombosit dan agregatnya menyebabkan peningkatan indikator ini).
Metode untuk mempelajari fungsi agregasi trombosit
Tes agregasi hemolisat berdasarkan kemampuan hemolisat sel darah merah yang dicuci, sedang dipelajari untuk diternakkan 10-2 dan 10-6, menyebabkan agregasi dalam plasma ketika diaduk, mengandung sejumlah besar trombosit (rasio volume plasma sitrat dan hemolisat - 1,0:0,2). Waktu terjadinya agregasi diperhitungkan (normal pada konsentrasi hemolisat yang tinggi—11-17 detik, pada rendah - 40-54 detik) dan tingkat keparahannya. Dinamika proses dan intensitasnya juga dapat dinilai secara fotometrik (kolorimeter medis, penyaring hijau, pengadukan) dan pada agregograf desain apa pun.
Saat mencatat proses secara grafis, gunakan hemolisat dengan pengenceran tinggi (10-6) memungkinkan Anda mendapatkan agregogram dua gelombang, di mana gelombang kedua dikaitkan dengan pelepasan stimulator agregasi endogen dari trombosit - ADP, katekolamin, tromboksan, dll.. Gelombang kedua ini menjadi ciri reaksi pembebasan, hal ini tidak diamati jika tidak ada butiran padat pada trombosit (penyakit kolam penyimpanan) atau jika terjadi pelanggaran reaksi pelepasan (sindrom seperti aspirin, dll.).
Uji agregasi hemolisat dapat dilakukan di laboratorium mana pun, tidak memerlukan reagen khusus.
Metode mikro visual untuk menentukan agregasi trombosit
Esensinya terletak pada kenyataan, bahwa darah vena yang diperoleh dalam kondisi silikonisasi distabilkan dengan volume ganda 3,8 % natrium sitrat (perbandingan 2,4:0,6 ml), itu disentrifugasi 6 menit pada 100 rpm, setelah itu plasma kaya trombosit yang dihasilkan diterapkan 0,02 ml ke slide kaca dan dicampur dengan bahan agregat dengan volume yang sama - ADP, trombin, kolagen, norepinefrin atau ristomisin. Konsentrasi akhir agen agregasi dalam plasma darah yang diteliti seharusnya:
- ADF 0,5*10-4 mmol/l;
- norepinefrin - 0,015%;
- trombin — 0,125 satuan/ml (konsentrasi kolagen dipilih secara eksperimental).
Dimungkinkan untuk menguji keduanya lebih rendah, dan konsentrasi agen agregasi yang lebih tinggi. Pemilihan konsentrasinya dapat bervariasi tergantung pada aktivitas obat yang tidak sama dari produsen yang berbeda dan aktivitas sampel yang berbeda, sehubungan dengan yang untuk pra-sesuai dengan konsentrasi masing-masing agen pada plasma yang normal.
Campuran kaya trombosit plasma menggabungkan agen dicampur dengan goyang slide, pada latar belakang gelap dengan kaca pembesar mencatat waktu dari penampilan unit sebagai "badai salju". Dalam menilai hasil dihitung jumlah trombosit dalam plasma. Jadi, ADP-time agregasi, meningkatkan 27-37 detik pada 400 T di 1 l trombosit untuk 62-75 detik pada 50 T di 1 l, dan trombin-agregasi - masing-masing, 40-52 untuk 79- 106 dari.
Agregasi pendaftaran grafis
Pendaftaran grafis agregasi bawah pengaruh agen diagregasi sama - metode yang sangat informatif studi platelet fungsional. Dilakukan pada atau agregografah.
Ketika grafis mendaftar menentukan tidak hanya timbulnya agregasi, namun intensitasnya (kurva deviasi terbesar dan daerah agregatogrammy), pertama dan kedua gelombang agregasi - bila menggunakan konsentrasi rendah epinefrin dan ADP (gelombang kedua mencirikan reaksi pembebasan), serta disagregasi patologis.
Pemeriksaan visual atau grafis dari agregasi trombosit di bawah pengaruh ristomisin
Sangat pemeriksaan visual atau grafis dari agregasi trombosit di bawah pengaruh ristomisin adalah penting. Jenis agregasi ini rusak (konsentrasi akhir ristomisin 0,8-1,0 mg/ml) dengan salah satu diatesis hemoragik yang paling umum - angiohemofilia (penyakit von Willebrand), serta dengan anomali trombosit Bernard-Soulier dan dengan beberapa jenis penghambatan sintesis faktor von Willebrand yang didapat (uremia, penghambatan kekebalannya, dll.. d.).
Penentuan kuantitatif faktor von Willebrand dalam plasma darah
Penentuan kuantitatif faktor von Willebrand dalam plasma darah dilakukan dengan aglutinasi ristomisin dari suspensi trombosit normal yang diformalkan dalam berbagai pengenceran plasma bebas trombosit yang diteliti..
Metode ini penting baik untuk diagnosis angiohemophnia dan penghambatan sekunder sintesis faktor ini, dan untuk menilai tingkat keparahan kerusakan endotel (vaskulitis, aterosklerosis, dll.) dan kecenderungan trombosis, dimana tingkat faktor von Willebrand dalam darah seringkali meningkat secara signifikan.
tingkat faktor von Willebrand menunjukkan kemampuan endotelium untuk mensintesisnya (berkurang pada aigiohemofilia) dan tingkat kerusakan endotel pada vaskulitis, aterosklerosis dan penyakit lainnya, terjadi dengan kerusakan pada lapisan dalam pembuluh darah.
Untuk mendapatkan trombosit normal yang tetap, trombosit ditambahkan secara berurutan ke plasma darah orang sehat yang kaya trombosit. 0,2 % solusi EDTA (0,5 ml 5 ml plasma) dan dengan 2 min - solusi perbaikan (20 ml 40 % formalin di 1000 ml buffer fosfat dengan 0,2 g EDTA, pH 6,4).
Campuran disimpan pada suhu setidaknya +4°C 1 tidak, setelah itu dilakukan sentrifugasi, supernatan dihilangkan, dan sedimen trombosit dicuci dua kali dengan larutan suspensi (satu volume 3,8 % larutan natrium sitrat dan lima volume larutan natrium klorida isotonik; pH disesuaikan menjadi 7,4). Suspensi trombosit normal yang diformalinisasi dikemas sesuai dengan 1 ml dan disimpan pada suhu -20°C. Kurva kalibrasi pengenceran dibuat menggunakan plasma normal bebas trombosit, dengan sampel yang trombositnya diformalkan telah dicampur. Selanjutnya, aglutinasi ristomisin ditentukan dalam campuran. Kurva kalibrasi digunakan untuk menentukan jumlah faktor von Willebrand dalam plasma darah yang diuji. Trombosit yang terfiksasi lebih baik diawetkan bila sejumlah kecil natrium azida ditambahkan ke dalam larutan pengawet.
Tes, mencerminkan agregasi trombosit secara spontan
Saat memeriksa pasien dengan tromboemboli atau dengan kecenderungan meningkat terhadap trombosis dan iskemia, tes termasuk dalam metode utama, mencerminkan agregasi trombosit secara spontan, t. Ini adalah. terjadi dalam darah utuh atau plasma darah tanpa penambahan agen agregasi.
Untuk mengidentifikasi fenomena ini, mikroskop apusan darah memperhatikan rasio jumlah trombosit individu dan agregatnya., terdiri dari 3-5 trombosit atau lebih. Fenomena ini lebih baik terungkap ketika melihat sedimen, diperoleh dengan zeitrif intensif- pencernaan plasma kaya trombosit (20—30 menit pukul 6000 / Min), distabilkan dengan larutan sitrat atau EDTA-sitrat. Namun, hasil yang lebih stabil diperoleh dengan metode penentuan agregasi spontan berikut ini.
Metode Wu-Hoak
Metode Wu-Hoak didasarkan pada, darah itu diambil dari vena ke dalam dua tabung reaksi, salah satunya berisi larutan EDTA, dan yang lainnya - campuran larutan EDTA yang sama dengan 4 % larutan formaldehida. Setelah tercampur, isi tabung dibiarkan mengendap 30 menit pada suhu kamar.
Selama pengendapan, agregat mengendap, dan masing-masing trombosit tetap berada di lapisan supernatan. Setelah mengendap, dihitung jumlah trombosit pada lapisan supernatan di setiap tabung. Biasanya perbedaan jumlah trombosit pada isi kedua tabung tidak melebihi 10-15 %, dengan peningkatan agregasi spontan, itu meningkat.
Metode N. DAN. Tarasova
Menurut metode N. DAN. Tarasova (1984) hilangnya trombosit dari darah sitrat utuh menjadi agregat diperhitungkan setelah dikocok selama 3 menit pada pengocok AVU-1 dengan kecepatan 90-100 kali per 1 m.
Dalam tabung reaksi dengan 0,5 ml darah, terguncang, diperkenalkan 1 ml 1 % larutan formaldehida dalam larutan natrium klorida isotonik. Tabung kendali kedua tidak diguncang, dan ke dalam darah yang terkandung di dalamnya dari orang yang sama yang diperiksa 3 larutan formalin min juga disuntikkan.
Darah di kedua tabung pendukung 30 m, setelah itu supernatan dihitung dalam jumlah trombosit. Biasanya, perbedaan platelet counts tidak melebihi 20 %, pada kecenderungan tinggi untuk agregasi, meningkatkan.
Dalam kasus pelanggaran dalam penerapan tes dasar, karakteristik hemostasis platelet, mengoperasikan sejauh yang diperlukan untuk melakukan studi tambahan. Dari jumlah tersebut yang paling penting adalah sebagai berikut.
Studi tambahan untuk menentukan hemostasis platelet
Kajian jumlah megakariosit pada myelogram dan trephine sumsum tulang dengan kajian morfologi sel-sel tersebut
Peningkatan signifikan dalam jumlah megakariosit di bagian sumsum tulang, biasanya dikombinasikan dengan peningkatan jumlah trombosit dalam darah yang kurang lebih jelas, diamati dengan eritremia, trombositosis hemoragik dan esensial serta penyakit mieloproliferatif lainnya. Megakariositosis sedang, dikombinasikan dengan trombositopenia, karakteristik purpura trombositopenik (penyakit Werlhof).
Dengan aplasia sumsum tulang dan hipoplasia asal mana pun, kandungan megakariosit di bagian sumsum tulang berkurang, dan jumlah trombosit dalam darah tepi.
Amegakariositosis parsial diamati dengan defisiensi trombositopoietin (suatu bentuk trombositopenia kongenital yang langka), munculnya antibodi antimegakariosit dalam darah, aplasia parsial esensial megakariosit (mungkin mendahului perkembangan leukemia).
Perubahan morfologi dan sitokimia pada megakariosit diamati pada banyak trombositopati.
Studi mikroskopis elektron ultrastruktur trombosit
Studi mikroskopis elektron pada ultrastruktur trombosit penting untuk diagnosis sejumlah trombositopati, di mana jumlah butiran non-protein dengan kepadatan optik tinggi tidak ada atau berkurang tajam (mengandung ADP, Serotonin, katekolamin, kalsium, dll.), atau butiran protein α, yang khas untuk sejumlah trombositopati, dikelompokkan ke dalam kelompok penyakit kumpulan penyimpanan, atau penyakit defisiensi granul.
Cacat pada alat kontraktil juga dapat dideteksi. (sistem mikrotubulus) dan lisosom trombosit.
Saat memindai mikroskop elektron atau mempelajari trombosit menggunakan optik interferensi menurut Nomarski, cacat pada fiksasi trombosit pada permukaan asing juga dapat dideteksi., mereka menyebar padanya, formasi menembak, sentralisasi dan sekresi butiran, yang khas untuk banyak jenis trombositopati.
Penentuan antibodi antiplatelet dengan imunofluoresensi- penelitian dalam suspensi trombosit imunoglobulin, berhubungan dengan sel-sel ini – metode Dixon
Metode canggih ini memungkinkan untuk membedakan antara trombositopenia imun dan non-imun..
Namun, dalam bentuk penyakit yang paling parah dengan trombositopenia parah, hal ini tidak dapat diterima, karena penentuan imunoglobulin terikat memerlukan waktu yang cukup besar (lebih dari 40-50 G masuk 1 l) jumlah trombosit.
Penentuan umur trombosit autologus berlabel
Penentuan umur trombosit autologus yang diberi label memungkinkan untuk membedakan trombositopenia dari umur normal trombosit dalam sirkulasi. (tentang 9 Malam) dan bentuk penyakit dengan umur sel yang lebih pendek.
Yang pertama paling sering dikaitkan dengan penurunan produksi trombosit di sumsum tulang, yang kedua - dengan percepatan kematian mereka, atau dengan aksi antibodi antiplatelet (dengan trombositopenia autoimun, umur trombosit berkurang hingga beberapa jam), atau dengan hilangnya sel-sel ini secara intensif menjadi agregat dan trombus dengan koagulasi intravaskular diseminata atau trombosis masif (konsumsi trombositopenia).
Penentuan kuantitatif kandungan plasma darah sebelum dan sesudah agregasi faktor trombosit
Penentuan kuantitatif kandungan plasma darah sebelum dan sesudah agregasi sejumlah faktor trombosit - faktor fosfolipid membran 3, isi butiran α (faktor antiheparin 4, -tromboglobulin, faktor mitogenik trombosit) dan butiran non-protein dengan kepadatan elektron-optik yang tinggi (Serotonin, katekolamin, ADF), serta hidrolase asam.
Studi-studi ini memberikan wawasan tentang isi struktur yang relevan dan komponennya dalam trombosit, tentang pelepasannya ke dalam plasma selama proses agregasi, dan juga tentang internal- aktivasi trombosit vaskular, disertai dengan pelepasan trombosit ke dalam plasma darah dengan peningkatan konsentrasi komponen padat dan butiran α pada plasma darah (faktor antiheparin 4, β-tromboglobulin, dll.).
Metode penelitian kuantitatif faktor trombosit penting untuk mengidentifikasi sejumlah trombositopati (pelanggaran keamanan butiran dan komponennya, paresis reaksi untuk pelepasan komponen-komponen ini, peningkatan kandungannya dalam plasma darah karena internal yang intens- adhesi pembuluh darah dan agregasi trombosit, dll.). Sejumlah trombositopati ditandai dengan penurunan kandungan faktor trombosit dalam membran 3 atau pelanggaran ketersediaannya untuk berpartisipasi dalam proses pembekuan darah.
Studi tentang karakteristik biokimia trombosit dan struktur individualnya
Studi tentang karakteristik biokimia trombosit dan struktur individualnya - stroma, butiran, mitokondria, dll.. d. memungkinkan Anda mendokumentasikan hubungan antara berbagai jenis patologi dan disfungsi trombosit dengan jenis defisiensi enzim tertentu (defisiensi siklooksigenase, tromboksan sintetase, dll.), dengan pelanggaran komposisi lipoprotein membran, diperlukan untuk interaksi dengan agen agregasi, dan t. d.
Studi semacam itu hanya tersedia di laboratorium penelitian yang lengkap dan oleh karena itu tidak digunakan dalam praktik luas..
