Aveu: mode d'emploi du médicament, structure, Contre-
Groupe clinique et pharmacologique: La préparation de facteur de coagulation sanguine VIII
Groupe pharmaco-thérapeutique: Hemostat
Aveu: effet pharmacologique
Le complexe facteur VIII/facteur Willebrand est constitué de deux molécules (facteur VIII et facteur von Willebrand), ayant des fonctions physiologiques différentes. Le médicament a été produit par la technologie recombinante dans la culture de cellules ovariennes de hamster chinois, pas de protéines d'origine humaine ou animale ajoutées lors du processus de fabrication.
Préparation Adveit® contient du facteur VIII de coagulation recombinant (oktokog alpha), qui est une glycoprotéine avec la séquence d'acides aminés, similaire au facteur VIII humain.
Octocog alfa est une glycoprotéine, consistant en 2332 acides aminés de poids moléculaire approximatif 280 kDa. Lorsqu'il est administré à des patients, l'octocog alfa se lie au facteur von Willebrand endogène.. Le facteur VIII activé agit comme cofacteur du facteur IX activé, accélérer la conversion du facteur X en facteur X activé. Le facteur X activé favorise la conversion de la prothrombine en thrombine. Thrombine, à son tour, favorise la conversion du fibrinogène en fibrine, ce qui conduit à la formation d'un thrombus (caillot de sang).
L'hémophilie A est héréditaire, liés au genre, violation du système de coagulation sanguine avec une diminution du niveau d'activité du facteur VIII. Se manifeste cliniquement par des saignements abondants dans les articulations, muscles ou organes internes, aussi spontané, et résultant d'un traumatisme ou d'une intervention chirurgicale. Pendant le traitement substitutif, le niveau de facteur VIII dans le plasma augmente, entraînant une correction temporaire du déficit en facteur dans le plasma sanguin et une diminution de la tendance à l'augmentation des saignements.
Aveu: pharmacocinétique
Toutes les études pharmacocinétiques d'Adveit® menée avec la participation des patients, déjà traité pour l'hémophilie A sévère ou modérément sévère (facteur VIII de base ≤ 2 %). Généralement, des données pharmacocinétiques sommaires ont été obtenues et analysées dans 195 patients précédemment traités, atteint d'hémophilie A sévère (facteur VIII de base <1%).
Tableau 1. Paramètres pharmacocinétiques d'Adveit® chez les patients de divers groupes d'âge atteints d'hémophilie A grave (facteur VIII de base <1%)
| Option (moyenne ± écart-type) | Bébés 1 MO-<2 année (n=5) | Enfants 2-<5 années (n=30) | Enfants 5-<12 années (n=18) | Ados 12-<18 années (n=33) | Adulte (n = 109) |
| ASC0-∞ (ME × h / dl) | 1362.1±311,8 | 1180.0±432,7 | 1506.6±530,0 | 1317.1±438,6 | 1538.5±529,1 |
| Accumulation de récupération de C ajustéemaximum (UI/dl d'UI/kg)* | 2.2±0,6 | 1.8± 0,4 | 2.0±0,5 | 2.1±0,6 | 2.2±0,6 |
| T1/2 (non) | 9.0±1,5 | 9.6±1,7 | 11.8±3,8 | 12.1±3,2 | 12.9±4,3 |
| Cmaximum dans le plasma après perfusion (MOI / dl) | 110.5±30,2 | 90.8±19,1 | 100.5±25,6 | 107.6±27,6 | 111.3±27,1 |
| Temps moyen de circulation plasmatique (non) | 11.0±2,8 | 12.0±2,7 | 15.1±4,7 | 15.0±5,0 | 16.2±6,1 |
| Vré à l'équilibre (dl/kg) | 0.4±0,1 | 0.5±0,1 | 0.5±0,2 | 0.6±0,2 | 0.5±0,2 |
| Dégagement (ml /(kg×ч)) | 3.9±0,9 | 4.8±1,5 | 3.8±1,5 | 4.1±1,0 | 3.6±1,2 |
* Calculé comme (DEmaximum moins le facteur VIII de base) diviser par dose (UI / kg), où Cmaximum – taux maximal de facteur VIII, déterminé après l'introduction.
Sécurité et efficacité hémostatique d'Adveit® chez les enfants similaire à la sécurité et à l'efficacité hémostatique chez les adultes.
Taux de récupération ajusté et T1/2 en phase finale chez les patients de moins de 6 les années étaient passées 20% Moins, que chez l'adulte, ce qui peut s'expliquer en partie par le volume plasmatique élevé par kg de poids corporel chez les enfants.
Actuellement, il n'y a pas de données sur les paramètres de la pharmacocinétique du médicament Adveit® patients, précédemment non traité.
Indications du médicament Adveit®
- traitement et prévention des saignements chez les adultes et les enfants de tous âges, les personnes atteintes d'hémophilie A (déficit héréditaire en facteur VIII).
Préparation Adveit® ne contient pas le facteur von Willebrand dans la quantité, nécessaire pour obtenir un effet pharmacologique, par conséquent indiqués pour le traitement de la maladie de von Willebrand.
Ouvrir la liste des codes CIM-10
Aveu: schéma posologique
Le traitement avec le médicament doit être commencé sous la supervision d'un médecin., expérimenté dans le traitement de l'hémophilie, et s'il existe une possibilité de réanimation immédiate en cas d'anaphylaxie.
Les doses et la durée du traitement dépendent du degré de déficit en facteur VIII., emplacement et intensité des saignements, ainsi que l'état clinique du patient. Une surveillance attentive en laboratoire du traitement substitutif est particulièrement importante en cas d'intervention chirurgicale majeure et d'hémorragie menaçant le pronostic vital..
La puissance des médicaments à base de facteur VIII est généralement exprimée en unités internationales. (MOI), selon les normes internationales de l'OMS. L'activité du facteur VIII plasmatique est exprimée soit en pourcentage (par rapport au plasma humain normal) ou en MOI (par rapport à la norme internationale).
Une unité internationale (MOI) l'activité du facteur VIII est équivalente à la quantité de facteur VIII, qui est contenu dans 1 ml de plasma humain normal.
Traitement “sur demande”
Le calcul de la dose nécessaire de facteur VIII est basé sur des données empiriques, selon laquelle la préparation du facteur VIII, dosé 1 Moi et 1 kg de poids corporel, augmente l'activité du facteur VIII plasmatique de 2 MOI / dl.
Dose requise d'Adveit® déterminé par la formule:
La dose requise (MOI) = poids corporel (kg) × requis % augmentation du facteur VIII × 0.5
Pour les saignements et les situations cliniques, indiqué dans les tableaux 2 et 3, l'activité du facteur VIII ne doit pas descendre en dessous d'un niveau prédéterminé (exprimée en % d'une activité normale ou en UI/dL) pour la période correspondante. Lors du choix d'une dose et d'une fréquence d'administration pour les épisodes de saignement et les interventions chirurgicales, vous pouvez être guidé par les tableaux 2 et 3.
Tableau 2. L'utilisation du médicament Adveit® avec divers types de saignement
| Degré de saignement | Activité de facteur VIII requise après administration (dans % normal ou UI/dl) | La fréquence d'administration (intervalle entre les injections en heures)/Durée du traitement (en jours) |
| Premiers signes d'hémarthrose, hémorragie dans les muscles ou saignement dans la bouche. | 20-40 | Les injections sont répétées tous les 12-24 non (tous 8-24 h pour les patients plus jeunes 6 années) pour au moins 1 jours avant le saignement, comme en témoigne l'absence de douleur, ou jusqu'au rétablissement complet. |
| Hémarthrose plus prononcée, saignement dans les muscles ou hématome. | 30-60 | Les injections sont répétées tous les 12-24 non (tous 8-24 h pour les patients plus jeunes 6 années) pendant 3-4 jours ou plus jusqu'au soulagement de la douleur et à la restauration de l'activité motrice. |
| saignement de la vie en danger. | 60-100 | Les injections sont répétées tous les 8-24 non (tous 6-12 h pour les patients plus jeunes 6 années) jusqu'à ce que le saignement s'arrête complètement et que la menace pour la vie soit éliminée. |
Tableau 3. L'utilisation du médicament Adveit® lors d'interventions chirurgicales
| Type de chirurgie | Activité de facteur VIII requise après administration (dans % normal ou UI/dl) | La fréquence d'administration (intervalle entre les injections en heures)/la durée du traitement (en jours) |
| Chirurgie mineure, y compris l'extraction dentaire. | 30-60 | entrer chaque 24 non (tous 12-24 h pour les patients plus jeunes 6 années) pour au moins 1 jours jusqu'à la guérison. |
| Interventions chirurgicales majeures. | 80-100 (avant et après la chirurgie) | Les injections sont répétées tous les 8-24 non (tous 6-24 h pour les patients plus jeunes 6 années) jusqu'à cicatrisation adéquate, puis continuer le traitement pendant au moins 7 jours, maintien de l'activité du facteur VIII allant de 30% à 60% (MOI / dl). |
La dose et la fréquence d'administration doivent être adaptées individuellement à la réponse clinique.. Dans certaines circonstances (par exemple,, en présence d'inhibiteurs à faible titre) des doses peuvent être nécessaires, dépassement calculé.
Au cours du traitement, le taux de facteur VIII de coagulation dans le plasma doit être déterminé afin de, adapter la dose ou la fréquence d'administration, si nécessaire.
Lors de la réalisation d'interventions chirurgicales majeures, il est obligatoire de surveiller la thérapie de remplacement en déterminant l'activité du facteur VIII dans le plasma..
Les patients peuvent avoir des réponses cliniques différentes au traitement par le facteur VIII., atteindre différentes valeurs de paramètres pharmacocinétiques, en particulier, T1/2 et taux de récupération in vivo.
Prévention des saignements
Pour la prévention à long terme des hémorragies chez les patients atteints d'hémophilie A sévère, les doses se situent généralement entre 20 à 40 Facteur VIII ME par kg de poids corporel avec un intervalle entre les injections de 2 à 3 jours.
L'utilisation du médicament chez les enfants
Lors de l'utilisation du médicament dans le mode “sur demande” doses recommandées et fréquence d'administration d'Adveit® dans enfants âgés de 0 à 18 années De même, comme chez les patients adultes. Pour la prévention à long terme des saignements chez les patients de moins 6 années il est recommandé d'utiliser le médicament à une dose de 20 à 50 Facteur VIII ME par kg de poids corporel 3-4 fois par semaine.
Mode de demande
Le médicament est destiné exclusivement à l'administration intraveineuse.. Si le médicament est administré par une personne, qui n'a pas de formation médicale spécialisée, alors cette personne devrait recevoir une formation appropriée sur l'administration d'Adveit®. La vitesse d'administration du médicament doit être choisie de manière à, offrir au patient un maximum de confort. Le taux d'administration ne doit pas dépasser 10 ml / min. Recommandé, dans l'intérêt du patient, chaque fois que vous administrez un médicament, notez le nom du médicament et le numéro de lot.
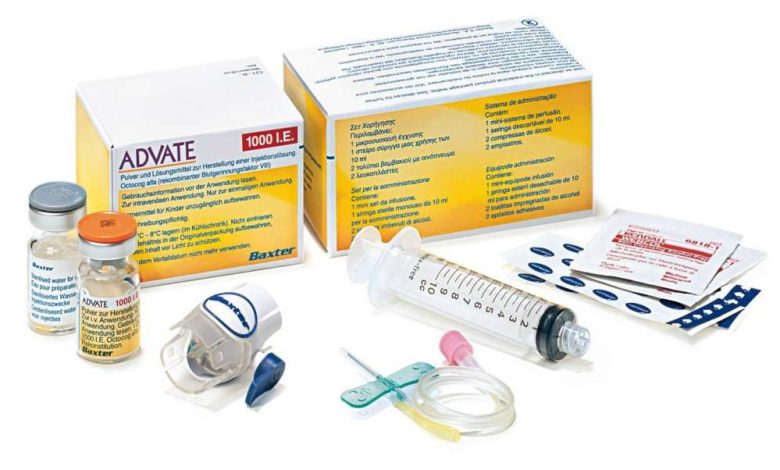
Préparation Adveit® doit être administré par voie intraveineuse après reconstitution du lyophilisat avec de l'eau stérile pour injection. La solution reconstituée doit être limpide, incolore et exempt d'inclusions mécaniques. Ne pas utiliser de solution trouble ou de solution, contenant des particules visibles.
- Pour administrer le médicament, vous devez utiliser une seringue avec un embout Luer..
- Le médicament doit être utilisé dans 3 h après la récupération.
- Ne placez pas le médicament reconstitué au réfrigérateur.
- Tout médicament ou résidu non utilisé doit être éliminé conformément aux exigences établies..
Elevage avec l'appareil BAXJECT II
- Respecter les règles d'asepsie.
- Pour reconstituer le médicament, utilisez uniquement de l'eau stérile pour injection et un dispositif de dilution, contenu dans le colis.
- N'utilisez pas l'appareil BAXJECT II, si son système de barrière stérile ou son emballage est endommagé, ou si vous remarquez des signes de dommages.
- Si le médicament a été conservé au réfrigérateur jusqu'à ce que la dilution, Apportez la température d'Adveit® (lyophilisat) et de l'eau stérile pour injection (solvant) jusqu'à la température ambiante (de 15° à 25°C).
1. Lave t'es mains, utiliser du savon et de l'eau chaude.
2. Retirer les bouchons des flacons de lyophilisat et de solvant.
3. Essuyez les bouchons avec des lingettes imbibées d'alcool. Placer les flacons sur une surface plane et propre.
4. Ouvrez l'emballage de l'appareil BAXJECT II en retirant la membrane en papier., sans toucher au contenu de l'emballage. Ne retirez pas l'appareil de l'emballage. Ne pas utiliser, si l'appareil BAXJECT II, son système de barrière stérile ou son emballage est endommagé.
5. Retournez l'emballage et insérez l'embout en plastique transparent dans le bouchon du flacon de solvant. Saisir les bords du colis, tirez-le vers le haut et retirez-le de l'appareil BAXJECT II. Ne retirez pas le capuchon bleu de l'appareil BAXJECT II.
6. Pour diluer le médicament, utilisez uniquement de l'eau stérile pour injection., contenu dans le colis. En fixant BAKSJECT II au flacon de solvant, retourner le système comme ça, de manière à ce que la bouteille de solvant soit au-dessus de l'appareil. Insérez l'embout en plastique blanc dans le bouchon du flacon d'Advate.® (lyophilisat). En raison du vide, le solvant s'écoulera dans le flacon avec Adveit®.
Tournez doucement le flacon jusqu'à ce que le médicament soit complètement dissous.. Chèque, cet adveit® (lyophilisat) complètement dissous, sinon, la substance active ne passera pas à travers le filtre de l'appareil. Le médicament se dissout rapidement (généralement moins de 1 m). La solution reconstituée doit être limpide, incolore et exempt d'inclusions mécaniques.
L'introduction de la drogue
Respecter les règles d'asepsie.
Avant utilisation, le médicament reconstitué doit être vérifié pour l'absence d'impuretés mécaniques.. Seule une solution claire et incolore doit être utilisée..
1. Retirez le capuchon bleu de l'appareil BAXJECT II. Ne pas aspirer d'air dans la seringue! Injecter la seringue dans BACSJECT II.
2. Retournez le système (le flacon de solution reconstituée doit être sur le dessus). Aspirer la solution reconstituée dans la seringue, rétractant lentement le piston.
3. Déconnecter la seringue.
Connecter l'aiguille papillon à la seringue. La solution doit être administrée dans/dans, lentement. Le taux d'administration du médicament ne doit pas dépasser 10 ml / min. Avant et pendant l'administration d'Adveit® le pouls du patient doit être surveillé. Avec une augmentation significative de la fréquence cardiaque, la réduction du taux d'administration du médicament ou l'arrêt temporaire de l'administration dans la plupart des cas permet d'arrêter rapidement ces symptômes.
Aveu: effet secondaire
Dans les essais cliniques d'Adveit® pris part 418 patients, obtention de, moins, une administration d'Adveit®. Étaient inscrits 93 réactions indésirables aux médicaments (NLR). Les effets indésirables les plus fréquemment signalés étaient :: apparition d'inhibiteurs (anticorps neutralisants contre le facteur VIII), maux de tête et fièvre.
Hypersensibilité ou réactions allergiques (pouvant inclure un œdème de Quincke, brûlure et démangeaisons au site d'injection, frissons, rougeur, urticaire généralisée, Mal de tête, urticaire localisée, gipotenziю, léthargie, nausée, anxiété, taxikardiju, rétrécissement Gruda, piquage, vomissement, respiration sifflante) observé rarement, mais dans certains cas a évolué vers une anaphylaxie sévère (y compris un choc anaphylactique). Des anticorps anti-protéines de souris et/ou de hamster et des réactions d'hypersensibilité associées peuvent survenir.
Les patients atteints d'hémophilie A peuvent développer des anticorps neutralisants (inhibiteurs) Facteur VIII. L'apparition de tels inhibiteurs se manifeste sous la forme d'une réponse clinique insuffisante.. Dans tous ces cas, il est recommandé de contacter un centre spécialisé en hémophilie.
Vous trouverez ci-dessous des données sur la fréquence des effets indésirables, informations sur lesquelles ont été obtenues dans des études cliniques et à partir de rapports spontanés. Les effets indésirables sont classés en fonction des dommages aux organes et aux systèmes d'organes; les noms des organes et des systèmes d'organes sont donnés conformément à la terminologie MedDRA.
La fréquence de survenue des effets indésirables a été évaluée conformément à la classification NLR de l'OMS en fonction de la fréquence de développement: Souvent (≥1 / 10), souvent (≥1 / 100 à <1/10), rarement (≥1 / 1000 à <1/100), rarement (≥1 / 10 000 à <1/1000 ), rarement (<1/10000), fréquence inconnue (ne peut être établi à partir des données disponibles). Au sein de chaque gradation de fréquence, les effets indésirables sont présentés par ordre décroissant de gravité.. La fréquence a été calculée par rapport au nombre total de patients, traité avec Adveit® (N = 418).
Maladies infectieuses et parasitaires: rarement – grippe, laringit.
A partir du système de sanguine et lymphatique: souvent – émergence des inhibiteurs du facteur VIIIà; rarement – limfangit.
Sur la partie du système immunitaire: fréquence inconnue – réaction anaphylactique, hypersensibilitéà.
A partir du système nerveux: souvent – mal de tête; rarement – vertiges, troubles de la mémoire, évanouissement, tremblement, migraine, disgevziya.
Sur la partie de l'organe de la vision: rarement – inflammation de l'oeil.
Système cardiovasculaire: rarement – palpitations, hématome, les bouffées de chaleur, pâleur.
Le système respiratoire: rarement – dyspnée.
A partir du système digestif: rarement – diarrhée, douleur dans le haut du ventre, nausée, vomissement.
Troubles cutanés et des tissus sous-cutanés: rarement – démangeaison, éruption, hyperhidrose, urticaire.
Troubles généraux et troubles au site d'injection: souvent – fièvre; rarement – œdème périphérique, douleurs à la poitrine, sensation d'inconfort dans la poitrine, frissons, changement de bien-être, hématome au site de ponction; fréquence inconnue – fatigabilité, des réactions au site d'injection, malaise.
Données de laboratoire et instrumentales: rarement – diminution des niveaux de facteur de coagulation VIIIet; augmentation du nombre de monocytes, diminution de l'hématocrite, écart par rapport à la norme dans les résultats des tests de laboratoire.
Blessures, intoxication et complications des manipulations: rarement – complication post-opératoire, saignement post-opératoire, réaction au site de la procédure.
et Une diminution inattendue des taux de facteur VIII s'est produite chez un patient au cours d'une perfusion continue d'Advate.® sur 10-14 jours après la chirurgie. Pendant cette période, l'hémostase a été maintenue. Les taux plasmatiques de facteur VIII et la clairance sont revenus à la normale au 15e jour postopératoire. Tests d'inhibiteurs du facteur VIII, réalisée à la fin de la perfusion continue et à la fin de l'étude, a donné des résultats négatifs.
à Des informations sur cet effet indésirable sont données ci-dessous..
Description des effets indésirables individuels
L'émergence des inhibiteurs du facteur VIII
Immunogénicité d'Adveit® a été étudié dans des essais cliniques impliquant 233 patients (enfants et adultes) atteint d'hémophilie A sévère (taux de facteur VIII ≤1 %) déjà traité avec des concentrés de facteur VIII (Pas moins que 150 jours d'administration chez les adultes et les enfants âgés de ≥ 6 ans et d'au moins 50 jours d'administration chez les enfants de moins de 6 années). Un patient après 26 jours d'administration d'Adveit® observé l'apparition d'inhibiteurs à faible titre (2.4 Unités Bethesda [ÊTRE] basé sur le test Bethesda modifié). Aucun inhibiteur n'a été détecté après la fin de la participation du patient à l'étude..
Durée médiane d'utilisation d'Advate® chez les patients précédemment traités dans toutes les études cliniques a été 97 jours (balayer de 1 à 709 jours d'introduction). Fréquence globale d'apparition des inhibiteurs (aussi haut, et faible titre) fait 0.4% (dans 1 de 233 patients).
Dans un essai clinique non contrôlé terminé 060103, dans 16 de 45 (35.6%) patients atteints d'hémophilie A sévère n'ayant jamais été traités (taux de facteur VIII ≤1 %), qui a reçu Adveit® pour au moins 25 jours d'application, inhibiteurs du facteur VIII développés. Dans 7 (15.6%) les patients avaient un titre élevé d'inhibiteurs et 9 (20%) patients – faible titre d'inhibiteurs (dont un patient, dans lequel l'apparition d'inhibiteurs a été classée comme transitoire).
Les facteurs de risque de développement d'inhibiteurs dans cette étude étaient: ethnie non caucasienne, antécédents familiaux d'inhibiteurs du facteur VIII et traitement intensif avec des doses élevées d'Advate® premier 20 jours d'introduction. Dans 20 patients, ceux qui n'avaient pas les facteurs de risque énumérés, l'apparition d'inhibiteurs n'a pas été notée.
Des données ont été obtenues sur l'induction de la tolérance immunitaire (ITI) chez les patients non traités auparavant, patients, dans lequel, lors de l'utilisation du médicament Adveit® Des inhibiteurs du facteur VIII ont été identifiés. Au cours de la sous-étude au sein de l'étude 060103 avec des malades, précédemment non traité, Le traitement IIT a été documenté dans 11 patients, précédemment non traité. Dans 30 patients atteints d'ITI (recherche 060703) une analyse rétrospective des dossiers médicaux a été réalisée. La collecte de données pour le registre des patients IIT est en cours.
Dans l’étude 060201 une analyse comparative de deux schémas de traitement prophylactique à long terme a été réalisée en 53 patients, précédemment traité (RLP): calendrier de dosage, sélectionnés sur la base de paramètres pharmacocinétiques individuels (à portée de 20 à 80 ME facteur VIII sur 1 kg de poids corporel à intervalles 72 ± 6 heures; n=23), et schéma posologique prophylactique standard (de 20 à 40 UI/kg chaque 48 ± 6 non; n=30). Objectif du schéma posologique, sélectionnés sur la base de paramètres pharmacocinétiques individuels (et calculé par une formule spéciale), était de maintenir un niveau minimum de facteur VIII ≥ 1 % à 72 heures d'intervalle entre les injections. Les données de cette étude prouvent, que les deux schémas posologiques prophylactiques sont comparables en termes de réduction des taux de saignement.
Effets indésirables, substances liées, utilisé dans le processus de production
De 229 patients, qui ont reçu un traitement avec Adveit® et ont été examinés pour la présence d'anticorps dirigés contre les protéines de cellules ovariennes de hamster chinois (SNO), dans 3 les patients ont montré une augmentation statistiquement significative du titre d'anticorps, dans 4 les patients ont montré des pics persistants ou des augmentations transitoires du titre d'anticorps, et chez un patient, il a été noté que, et autre. Tous ces changements dans les titres d'anticorps n'étaient pas accompagnés de manifestations cliniques..
Parmi ceux-ci 229 patients traités, qui ont reçu un traitement avec Adveit® et ont été examinés pour les anticorps dirigés contre l'immunoglobuline G de souris (IgG), dans 10 les patients ont montré une augmentation statistiquement significative du titre d'anticorps, dans 2 patients, des pics stables ou des augmentations transitoires du titre d'anticorps ont été détectés, et chez un patient, puis, et autre. Quatre de ces patients, des cas isolés d'urticaire ont été rapportés, démangeaisons, éruption, une légère augmentation du nombre d'éosinophiles (à tous les patients indiqués, le médicament Advate® injecté à plusieurs reprises).
Hypersensibilité
Les réactions de type allergique comprenaient l'anaphylaxie et se manifestaient par des étourdissements, paresthésie, éruption, marées, gonflement du visage, urticaire et démangeaisons.
L'utilisation du médicament chez les enfants
À l'exception de la formation d'inhibiteurs chez les patients précédemment non traités et des complications liées au cathéter, pas de différence dans la fréquence des effets indésirables, chez les patients de tous âges, n'ont pas été identifiés dans les études cliniques.
Signalement des effets indésirables suspectés
Les informations sur les effets indésirables suspectés vous permettent de surveiller en permanence le rapport bénéfice / risque du médicament Adveit®. Médecins, en utilisant le médicament Adveit® pour le traitement des patients atteints d'hémophilie A, doit signaler les effets indésirables suspectés, développé au cours de la période suivant la délivrance du certificat d'enregistrement du médicament, aux autorités nationales de pharmacovigilance conformément à la procédure standard.
Aveu: contre-indications d'utilisation
- hypersensibilité connue à la substance active ou à l'un des excipients, ainsi qu'aux protéines de souris/hamster.
Aveu: utiliser pendant la grossesse et l'allaitement
Influence du médicament Adveit® sur la fonction de reproduction des animaux n'a pas été étudiée. Car, que l'hémophilie A est extrêmement rare chez les femmes, sécurité du médicament Adveit® chez la femme enceinte et chez la femme allaitante n'a pas été établie. Avant de prescrire Adveit® pendant la grossesse et pendant l'allaitement, le médecin doit soigneusement peser le risque potentiel et le bénéfice attendu pour chaque patient.
Aveu: Instructions spéciales
Réactions d’hypersensibilité
Avec le sur / dans l'introduction de préparations protéiques, le développement de réactions allergiques est possible.. Préparation Adveit® est une protéine, et contient également des traces de protéines de souris et de hamster.
Lors de l'utilisation du médicament Advate® Des réactions d'hypersensibilité de type allergique ont été rapportées, y compris l'anaphylaxie. Les patients doivent être informés des premiers signes de réactions d'hypersensibilité immédiates., comme l'urticaire, démangeaison, éruption cutanée généralisée, œdème de Quincke, hypotension (accompagné de vertiges et d'évanouissements), choc et détresse respiratoire aiguë (oppression thoracique, respiration sifflante). Les patients doivent être avisés si ces symptômes surviennent d'arrêter immédiatement d'utiliser le médicament et de contacter leur médecin.. En cas de choc, des mesures anti-choc généralement acceptées doivent être prises..
Formation d'inhibiteurs du facteur VIII
L'émergence d'anticorps neutralisants contre le facteur VIII (inhibiteurs) est une complication connue dans le traitement des patients atteints d'hémophilie A, qui se manifeste cliniquement par une diminution de l'activité procoagulante du médicament facteur VIII. Les inhibiteurs sont des immunoglobulines de classe G. Le titre des inhibiteurs est mesuré en unités Bethesda. (ÊTRE) par ml de plasma en utilisant la méthode Bethesda modifiée.
Avec l'apparition d'inhibiteurs du facteur VIII, les patients peuvent présenter une réponse clinique insuffisante à Advate.®. Dans ce cas, il est recommandé de contacter un centre de traitement spécialisé en hémophilie.. Le risque de développer des inhibiteurs est en corrélation avec la durée d'utilisation du facteur VIII. (le risque est le plus élevé pendant la première 20 jours d'introduction), ainsi que des facteurs génétiques et environnementaux. Rarement, des inhibiteurs peuvent apparaître après le premier 100 jours d'introduction.
Il y a eu des cas de reformation d'inhibiteurs (à faible titre) chez les patients précédemment traités, ayant des antécédents d'inhibiteurs, (traité pendant plus de 100 jours d'introduction) après le passage d'un patient d'un facteur VIII à un autre. Par conséquent, après le passage d'un traitement avec un facteur VIII à un autre, une surveillance constante doit être effectuée. (en tant que clinique, ainsi qu'un laboratoire) pour les malades, traité avec un médicament facteur VIII, pour la détection précoce des inhibiteurs.
Généralement, pour les malades, traité avec des médicaments de facteur VIII de la coagulation, doivent être soigneusement surveillés pour détecter l'apparition d'inhibiteurs par une observation clinique appropriée et des tests de laboratoire. Si le niveau attendu d'activité plasmatique du facteur VIII n'est pas atteint, ou si une dose adéquate ne parvient pas à contrôler le saignement, un test approprié doit être effectué pour détecter les inhibiteurs du facteur VIII. Le traitement peut ne pas être efficace chez les patients présentant des taux élevés d'inhibiteurs du facteur VIII, il faut envisager l'utilisation de thérapies alternatives. Ces patients doivent être traités par un médecin., expérimenté dans le traitement de l'hémophilie en présence d'inhibiteurs du facteur VIII.
Thérapie préventive avec Adveit® avec sélection de dose individualisée
Pour maintenir les taux de facteur VIII de base ≥ 1 % à l'intervalle des doses, composant 72 non, dose unique d'Advate® peut être sélectionné individuellement par un médecin, en tenant compte des valeurs des paramètres pharmacocinétiques individuels. Dans une étude clinique, il a été montré, que le schéma posologique prophylactique 20-40 UI/kg toutes les 48 ± 6 h a une efficacité clinique similaire au régime 20-80 ME / kg avec un intervalle de 72 ± 6 h, avec une réduction significative des taux de saignement avec un traitement prophylactique par rapport au traitement à la demande.
Le schéma prophylactique standard avec l'administration du médicament tous les deux jours et le schéma de traitement prophylactique individuel avec sélection de dose en fonction des paramètres pharmacocinétiques et avec l'administration du médicament tous les trois jours ont une efficacité comparable..
Complications associées au cathéter pendant le traitement
Si un dispositif d'accès veineux central est requis, alors il y a un risque de développer des complications associées au cathéter, comme une infection locale, bactériémie, thrombose au site du cathéter.
Informations, concernant les excipients
Après reconstitution, la solution médicamenteuse contient 0.45 mmol de sodium (10 mg) par flacon. Il devrait être tenu compte lors de la désignation des patients de la drogue, situé sur un régime de restriction de sodium.
Utilisez en pédiatrie
Les mises en garde et précautions spéciales indiquées s'appliquent aux enfants., dans la même mesure, idem pour les adultes.
Instructions spéciales pour le stockage et l'utilisation
Pour éliminer la possibilité de contamination microbiologique, le médicament doit être administré immédiatement après la préparation de la solution. Cependant, il a été prouvé, que la solution préparée d'Adveit® chimiquement et physiquement stable dans le temps 3 h à 25°C.
Dans la date d'expiration, le médicament peut être conservé à température ambiante (au-dessus de 25 ° C) dans un délai 6 mois. La date de début et la date de fin de stockage du médicament à température ambiante doivent être enregistrées sur l'emballage du médicament.. Après stockage à température ambiante, ne placez pas le médicament pour un stockage ultérieur dans le réfrigérateur..
Recommandé à chaque administration d'Adveit® enregistrer le nom du médicament et le numéro de lot dans le dossier médical pour pouvoir établir un lien entre le patient et le lot du médicament.
L'effet sur l'aptitude à conduire des véhicules et des mécanismes
Préparation Adveit® n'affecte pas la capacité de conduire des véhicules et la capacité de travailler avec des mécanismes.
Aveu: surdosage
Aucun cas de surdosage de préparations de facteur VIII de coagulation sanguine recombinant n'a été signalé.. Symptômes de surdosage inconnus.
Aveu: interaction médicamenteuse
Aucune étude d'interaction d'Adveit® avec d'autres médicaments n'a été menée..
Aveu: conditions de conservation d'Adveit®
Le médicament doit être conservé dans une boîte en carton à l'abri de la lumière., dans un endroit inaccessible aux enfants à une température de 2° à 8°C; Ne pas congeler.
Aveu: durée de conservation d'Adveit®
Durée de vie – 2 année. Ne pas utiliser après la date d'expiration.
Aveu: conditions de mise en œuvre
Le médicament est libéré sous la prescription.
