Фибринолиз — Система гемостаза
Ферментная система, вызывающая асимметричное расщепление фибрина/фибриногена на все более и более мелкие фрагменты, носит название фибринолитической, или плазминовой.
Главным компонентом этой системы является фермент плазмин (фибринолизин), содержащийся в плазме крови в виде профермента (плазминогена) в количестве около 0,2 г/л.
В циркулирующей крови плазминоген встречается в двух основных формах:
- в виде нативного профермента с NH2-терминальной глутаминовой кислотой — глу—плазминогена;
- в виде частично подвергшегося протеолизу лиз-плазминогена, который в 10—20 раз быстрее, чем глу-плазминоген, трансформируется физиологическими активаторами в плазмин, имеет намного более высокое сродство к фибрину и быстрее метаболизируется, чем глу-плазминоген (период полужизни в крови соответственно составляет 0,8 и 1,24 суток).
Активный плазмин быстро блокируется антиплазминами и элиминируется из кровотока. Вследствие этого после введения стрептокиназы или урокиназы уровень плазминогена в крови очень быстро и сильно снижается (при больших терапевтических дозах почти до нуля), а затем, если прекращена дальнейшая его активация, в течение 18—28 ч восстанавливается. Эта способность активаторов плазминогена быстро истощать запасы указанного профермента должна учитываться при лечении тромбозов.
Активация фибринолиза в организме, как и активация свертывания крови, может осуществляться как по внешнему, так и по внутреннему механизму.
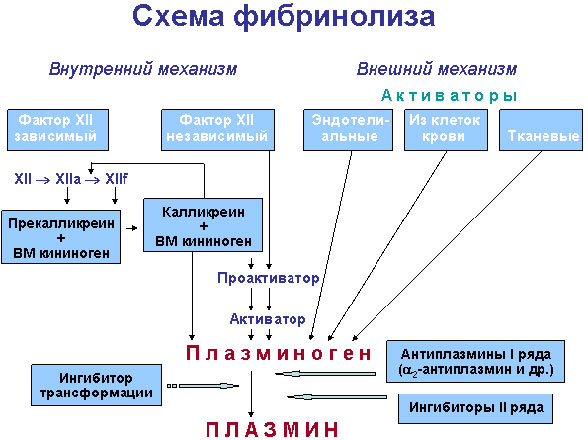
Внутренний механизм может запускаться теми же факторами, что и свертывание крови, т. е. комплексом XIIа или XIIf с калликреином и высокомолекулярным кининогеном. Активность этого механизма оценивается по скорости лизиса эуглобулиновой фракции, полученной из крови, предварительно активированной контактом (каолином). Наряду с этим фактор-XIIa-зависимым лизисом существует еще какой-то механизм внутренней активации (примерно равный по силе), стимуляторы которого пока не определены.
Внешняя активация фибринолиза осуществляется в основном синтезируемым в эндотелии сосудов так называемым белковым активатором тканевого типа (АТТ). Идентичные или очень сходные с ним активаторы содержатся во многих тканях и жидкостях организма, но эндотелиальный легче всего поступает в кровоток. Интенсивный выброс его происходит при всех видах закупорки сосудов, в том числе и при сжатии сосудов манжетой (на чем основана манжеточная проба), при различных физических нагрузках, под влиянием вазоактивных веществ и лекарственных средств — никотиновой кислоты, адреналина и норадреналина, аналогов вазопрессина и др.
Мощные активаторы плазминогена содержатся также в клетках крови — эритроцитах, тромбоцитах, лейкоцитах. Кроме того, гранулоциты и макрофаги могут секретировать внутриклеточные киназы, которые сами по себе, т. е. без участия плазмина, расщепляют фибрин.
Активаторы плазминогена содержатся также в различных тканях и секретах и экскретах — моче, молоке, желчи, слюне и др. Большинство из этих активаторов идентично сосудистому эндотелиальному. Очень большое количество активатора продуцируют и клетки некоторых опухолей (меланома).
Урокиназа, образующаяся в юкстгломерулярном комплексе почек и в основной массе выделяющаяся с мочой, отличается от других активаторов. В кровь она попадает в небольшом количестве, поэтому урокиназная активация составляет лишь около 15 % общей фибринолитической активности плазмы. Урокиназа широко используется в качестве лечебного препарата при необходимости получения тромболизиса. Известны две молекулярные формы этого активатора.
Из чужеродных активаторов фибринолиза в терапии тромбоэмболий чаще всего применяются различные виды стрептокиназы, реже — активаторы фибринолиза из других бактерий и грибов.
Фибринолиз ингибируется антиплазминами, из которых наиболее важен относящийся к α2-глобулинам (молекулярная масса — 65000—75000) быстродействующий антиплазмин, содержащийся в плазме в количестве 0,07 г/л и способный нейтрализовать около 2/3 всего плазмина, образующегося при полной активации плазминогена крови. Не менее важную роль играет недавно открытый быстродействующий антиактиватор, ингибирующий активатор фибринолиза тканевого типа (эндотелиальный активатор плазминогена).
Среди ингибиторов фибринолиза, обладающих более слабым действием, заслуживают внимания α2-макроглобулин, C1-эстеразный ингибитор, антитрипсин и др.
Альфа2-макроглобулин, соединяясь с плазмином, защищает последний от действия более мощного ингибитора α2-антиплазмина и вместе с тем препятствует действию плазмина на фибриноген, т. е. ориентирует этот протеолитический фермент на лизис фибрина.
Плазминовая система адаптирована к лизису фибрина в сгустках (тромбах) и в растворимых фибрин-мономерных комплексах (РФМК), в силу чего плазминовый лизис фибриногена и других белков (факторов V и VIII) возникает лишь при очень сильной ее активности (например, при внутривенном введении стрептокиназы или урокиназы). Этому способствует ряд механизмов, важнейшими из которых является связывание тканевого активатора, лиз-плазминогена и плазмина с фибрином, в силу чего в тромбах создается высокая концентрация компонентов фибринолитической системы, а также то, что эти фиксированные на тромбах компоненты слабо ин- гибируются антиактиваторами и анти- плазмином, тогда как свободно циркулирующий плазмин и его сосудистый активатор образуют со своими ингибиторами плохо диссоциирующие комплексы.
В связи с действием ингибиторов обычные сгустки крови, полученные в результате ее естественного свертывания в пробирках, подвергаются в нормальных условиях очень слабому лизису, наиболее доступным способом определения которого является исследование естественного лизиса сгустка по М. А. Котовщиковой и Б. И. Кузнику либо этот же тест в модификации Е. П. Иванова.
В отличие от этого, эуглобулиновый лизис (метод Ковальского или Коваржика) происходит достаточно быстро и полно, так как при выделении эуглобулиновой фракции плазминоген и его активаторы выпадают в осадок, тогда как ингибиторы фибринолиза (антиплазмин, антиактиватор) остаются в основной своей массе в надосадочной жидкости и не участвуют в реакции. Таким образом, при исследовании эуглобулинового лизиса ингибиторы фибринолиза искусственно удаляются из реагирующей смеси и практически определяется только активность плазмина и его активаторов. В силу этого ослабление (замедление) эуглобулинового лизиса говорит о сниженном содержании в исследуемой плазме крови активатора тканевого типа (эндотелиального) или плазминогена, а ускорение — о повышенном содержании активатора при достаточном количестве плазминогена.
Эуглобулиновый лизис определяется также внутренней XIIa-зависимой активацией фибринолитической системы. Поэтому преинкубация крови с каолином, вызывающим интенсивную контактную активацию фактора XII, прекалликреина и высокомолекулярного кининогена (в комплексе), сокращает время эуглобулинового лизиса с 2—4 ч до нескольких минут.
Активный плазмин вызывает последовательное асимметричное расщепление фибриногена/фибрина.
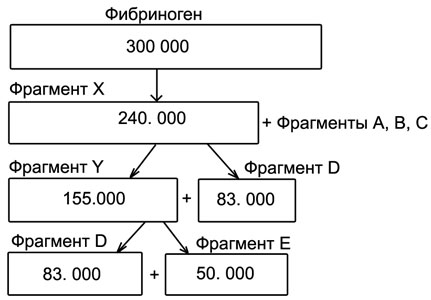
Вначале от его α- и β-цепей отщепляются низкомолекулярные фрагменты, суммарная масса которых составляет около 40000 дальтон. После их отщепления в плазме крови остается крупно молекулярный фрагмент X, который еще сохраняет способность образовывать фибрин (свертываться) под влиянием тромбина. Затем в результате действия плазмина фрагмент X расщепляется на фрагменты Y и D, а фрагмент Y — на фрагменты D и E. Крупномолекулярные продукты фибринолиза (фрагменты X и V) именуются ранними (они, как и растворимые фибрин-мономерные комплексы — РФМК, определяются с помощью тестов склеивания стафилококков, латекс-агглютинационным тестом), а фрагменты D и E — поздними, или конечными. Последние часто выявляются (особенно при фибринолизе, а не фибриногенолизе) в виде димеров D-D или тримеров D-D-E.
Поздние продукты фибринолиза выявляются иммунологически с помощью специфических антифибриногеновых сывороток (в этом случае определяется сумма продуктов фибринолиза I РФМК, если последние предварительно не были удалены) с помощью либо специфических антисывороток, либо яда змеи эфы. В норме содержание в сыворотке продуктов фибринолиза (ПДФ) менее 0,05 г/л (для исключения вторичного фибринолиза в пробирке кровь берут из вены, добавляя к ней немедленно аминокапроновую кислоту).
Повышенное содержание в крови ПДФ свидетельствует о происходящем в ней активном фибринолизе.
Первичное повышение фибринолитической активности (без предшествующего свертывания крови) — крайне редкое явление. Оно зарегистрировано в единичных случаях наследственного дефицита α2-антиплазмина, а из приобретенных форм — при меланоме, вырабатывающей большое количество активатора плазминогена тканевого типа. Предполагается также возможность активации фибринолиза без предварительного свертывания при тяжелых поражениях печени вследствие снижения синтеза в ней α2-антиплазмина. Однако, поскольку при таких поражениях развивается, как правило, ДВС-синдром, указанную активацию фибринолиза в подавляющем большинстве случаев следует связывать с предварительным свертыванием крови.
Таким образом, активация фибринолиза без предварительного свертывания крови — казуистика, если не считать искусственной активации вследствие применения стрептокиназы и ее производных, урокиназы, быстродействующего активатора тканевого типа (в последние годы выпускается как лечебный препарат) и других препаратов. В подавляющем же большинстве клинических ситуаций фибринолиз вторичен и связан либо с диссеминированным внутрисосудистым свертыванием крови, либо с массивными тромбоэмболиями, а также с интенсивной локальной гемокоагуляцией в органах или ангиомах. Поэтому повышение уровня ПДФ расценивается как показатель внутрисосудистой гемокоагуляции и вторичной активации фибринолиза.
Повышение уровня ПДФ при ДВС-синдроме и массивных тромбозах очень часто сочетается с замедлением эуглобулинового и XIIa-зависимого фибринолиза, со снижением содержания в крови плазминогена. В этом нет никакого противоречия, ибо фибринолиз с образованием ПДФ происходит в тромбах и микросгустках фибрина, где фиксируются плазминоген и его активатор, интенсивно образуется и быстро метаболизируется активный плазмин. Лизис в тромбах и сгустках приводит к поступлению в кровоток больших количеств ПДФ, но в силу убыли в тромбы плазминогена и его активатора количество последних в циркулирующей крови и плазме естественно снижается.
Таким образом, повышение уровня ПДФ в сочетании со снижением содержания в плазме крови плазминогена и его активатора — закономерные признаки интенсивного внутрисосудистого свертывания крови. Антиплазминовая активность при этом может как повышаться, так и оставаться нормальной или умеренно снижаться.
Вторым проявлением внутрисосудистого свертывания крови является циркуляция в кровотоке комплекса плазмин—антиплазмин (как и комплекса тромбин—антитромбин). Образование таких комплексов ингибиторов с активированными ферментами сопровождается появлением новых антигенных маркеров, которые отсутствуют в отдельности в ферментах (плазмина, тромбина) и их ингибиторах. Выявление этих неоантигенов используется в диагностике ДВС-синдрома и других видов внутрисосудистого свертывания крови.
Продукты, образующиеся в результате фибринолиза, биологически активны и оказывают влияние на проницаемость и тонус кровеносных сосудов, свойства эндотелия, ингибируют агрегацию тромбоцитов и самосборку мономеров фибрина (т. е. действуют как антиагреганты и антикоагулянты), тормозят фибринолиз, оказывают активирующее влияние на систему мононуклеарных фагоцитов, поглощаются этой системой и блокируют ее, взаимодействуют с системой комплемента и т. д.
