Virkningsmekanismen af lægemidler
I de fleste tilfælde,, lægemiddelstof (ligand) Det havde sin virkning, det skal opfylde kroppens specifikke komponenter - målreceptorerne, molekylstruktur, repræsenterer et protein, mindre nukleinsyre, lipid eller andre konfigurationer, anbragt inde i eller på overfladen af celler, med hvilken det interagerer, udløser en kæde af biokemiske og fysisk-kemiske processer, hvilket fører til visse virkninger.
Der er to typer af membranreceptorer - ionkanaler og receptorer, associeret med G-protein. For Eksempel, for adetilholina og lignende stoffer er kendetegnet ved en natriumkanal. Acetylcholin interagerer med kanalprotein, forårsager en konformationsændring i det, at bidrage til åbningen af kanalen og indtrængning af natriumioner i cellen. Denne proces ligger til grund neural stimulation. Nogle lægemidler, interagere med natriumkanalen proteinet, forhindre dens åbning, derved blokere transmissionen af nerve excitation.
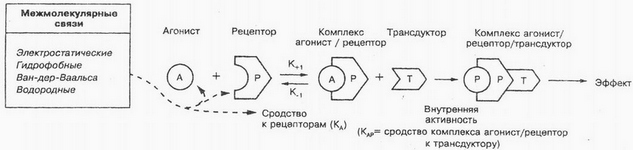
Til den indvendige side af plasmamembranen af celler slutter sig til den såkaldte G-protein, der tilvejebringer synkronisering af interaktionen af lægemidlet med den samtidige aktivering af de respektive intracellulære målproteiner. Som vist i figur, lægemiddelmolekyle vekselvirker med receptoren (P) på den ydre overflade af membranen, som forårsager konformationel ændring af receptorproteinet. Med denne G -belok ændrer sin rumlige struktur, migrerer til membranens plan enzymer, som er i en inaktiv tilstand inde i cellen. G-protein interaktion med enzymer (T) Det forårsager deres aktivering (LV / P / T). Noradrenalin, dopamin og andre ligander vekselvirker med receptorerne er, af G-protein. Det skal bemærkes,, at acetylcholin kan interagere ikke blot med kanalen protein, men også med receptorer, af G-protein.
For forekomsten af interaktion mellem liganden og behovet for at bioreceptors, at de har komplimentarnostyu, dvs. mellem dem der bør være en vis affinitet, eller affinitet (line størrelser, rumlige konfiguration, tilstedeværelse af modsatte ladninger, etc.. d.). For Eksempel, positiv ladning exogent ligand bør svare negativ ladning receptor, radikaler og upolære stoffer kan binde til hydrofobe regioner af receptoren.
Blandt de fysisk-kemiske egenskaber lægemiddelstoffer, påvirke deres interaktion med receptorer, bør fremhæve størrelsen af molekylet, afhængigt af stof, som kan interagere med hele receptoren eller dele af dens. Størrelsen af lægemiddelmolekylet er afhængige kinetik og dens penetration gennem biologiske membraner. Typisk med stigende størrelse af molekylet forøger dens fleksibilitet og mulighed for dannelse af van der Waals bindinger med den makromolekylære partner. Udover, vigtigt stereokemi lægemiddelmolekyle. Fra, isomere form, hvori lægemiddelstoffet er, Det afhænger af dets farmakologiske aktivitet. Og det skal tages i betragtning: mere stiv konformation af receptormolekylet, jo større forskel i virkningen af stereoisomerer.
lægemiddel-interaktion - receptoren på bekostning af intermolekylære bindinger. Oprindeligt er stoffet tiltrækkes til receptoren via elektrostatiske kræfter, og i nærværelse af komplementaritet - danner en forbindelse med receptoren ved hjælp af fysiske og fysisk-kemiske interaktioner (karakteriseret for lægemiddel, som udskilles fra organismen i uændret form eller maloizmenennom) eller kemiske vekselvirkninger (iboende til forbindelser, der undergår kemiske reaktioner i organismen). Fleste svage van der Waals-kræfter er involveret i bestemmelse af specificiteten af interaktionen mellem lægemidlet og biokemiske raketsystemer. Hydrogenbindinger involveret i de processer af anerkendelse og fastsættelse stof (ligand) til BIOSTRUCTURES. Ionbindinger forekomme i tilfælde, når lægemiddelstoffer indeholder kationisk eller anionisk gruppe, og de modstående strukturer er i bioreceptors. ionbindinger dannes ofte i de første faser af reaktionen mellem farmakologiske stoffer og receptorer. I sådanne tilfælde er virkningen af lægemidlet er reversibel. Vigtigt for dannelsen af koordinerings- covalente bindinger. De forekommer involverer interaktion med alkyleringsmidler biosubstrates, samt lægemidler og modgifte med metaller i dannelsen af stabile komplekser, chelater, f.eks, unitiola med arsen eller tetatsin-calcium med bly. Virkningen af disse stoffer er irreversibel.
Udover, hydrofob interaktion eksisterer. Selv energien af sine obligationer er lille, interaktion af et stort antal lange alifatiske kæder fører til stabile systemer. Hydrofobe interaktioner spiller en rolle i stabiliseringen af konformationer af biopolymerer og dannelsen af biologiske membraner.
Aminosyreresterne i proteinet receptormolekyler indeholde polære og ikke-polære grupper, som bestemmer dannelsen af polære og ikke-polære bindinger mellem dem og lægemidler. polære grupper (-Åh, -NH, COO, -N3H, = Den) giver undervisning, hovedsageligt, ioniske og hydrogenbindinger. polære grupper (hydrogen, methyl, cycliske grupper osv ..) danner hydrofobe bindinger med lav molekylvægt lægemiddelstoffer.
Således, lægemiddelinteraktion med specifikke receptorer kan skyldes forskellige kemiske bindinger, har ulige styrke. Så, eksemplariske styrke curariform stoffer til elektrostatisk holinoretseptorami (ion) interaktion er 5 kcal / mol, ion-dipol - 2-5 kcal / mol, dipol-dipol - 1-3 kcal / mol, hydrogenbindinger - 2-5 kcal / mol, van-der-Waals-bindinger - 0,5 kcal / mol, hydrofobe bindinger - 0,7 Én kcal pr CH2-gruppe. Faldende bindingsstyrke afhængigt af afstanden mellem atomer er den elektrostatiske vekselvirkning r-2, ion-dipol - r-3, dipol-dipol - r-4, hydrogenbindinger - r-4, van-der-Waals-bindinger - r-7. Denne form for forbindelse kan krænkes, tillader reversibilitet af virkningen af lægemidler. Er stærkere kovalente bindinger, som giver langsigtede og ofte irreversible virkninger af stoffer, f.eks, alkylerende anticancerlægemidler. De fleste lægemidler reversibelt binder til receptorer. Hvori, normalt, arten af forbindelsen er meget kompliceret: det kan deltage samtidigt ion, dipol-dipol, van der Waals, hydrofobe og andre former for kommunikation, som i høj grad af komplementaritet af stoffet og receptoren og, henholdsvis, grad af konvergens mellem en.
Styrken af bindingsstoffer til receptorerne, der betegnes med "affinitet". Stoffer, Den virker på de samme receptorer, kan have over for dem varierende grader af affinitet. Således stoffer med højere affinitet kan fortrænge materiale med mindre affinitet af forbindelserne til receptorer. At bestemme ligevægten mellem "besatte" receptorer (Dr), og frit receptormateriale (D) brugte dissociationskonstant (KD), som er defineret ved den følgende formel:
KD=[D]*[R]/[ Dr]
Den negative logaritme KD (pRD) Det er et mål for affiniteten. Til karakterisering af affinitet anvendes ofte indikator for pD2, t. Det er. den negative logaritme EF50, (koncentration af stoffet, hvor den bevirker, virkningen, komponent 50% af den maksimale effekt).
En række kemiske bindinger af samarbejde og deres ulige styrke, eller affinitet mellem liganden og kompleks struktur forklarede bioreceptors narkotika, indeholdende forskellige reaktiviteter med radikaler og multidimensional volumetrisk formular, samt kompleksiteten af samspilsprocesserne, ofte forekommer i flere etaper (fase): dannelsen af komplekset lægemiddel - receptor; intramolekylære gruppering; dissociation af komplekset.
Således, farmakologisk virkning kan forårsage kun stoffer med en udtalt affinitet for bioreceptors. Intensitet af virkningen afhænger af koncentrationen af lægemidlet og det samlede antal receptorer.
Hvis stoffer har tilstrækkelig iboende aktivitet, de kaldes agonister. Under iboende aktivitet betyder evnen af agonister til at forårsage en biologisk virkning ved at ændre konformationen af receptoren, t. Det er. evne til at aktivere receptorliganden. Dette fænomen betragtes som en kompleks affinitet agonist-receptor til traneduktoru, konvertering af de eksterne signaler til indre hed transduktion. Intracellulær signaltransduktion er grundlaget for fremgangsmåder, som sammentrækning af muskelfibre, celledeling, proliferation, differentiering, etc.. Det er nu etableret, at mange stoffer (hormoner, bioaktive peptider, nukleotider, steroider, lavmolekylære bioregulatorer et al.) celle har en specifik receptor. Interaktionen af disse stoffer med specifikke receptorer dannet af disse sekundære budbringere (mediatorer), at udløse en kaskade af biokemiske reaktioner.
Der er begrebet "partielle agonister"- narkotika, at, ved binding til receptorer, ikke giver den maksimale effekt. Dette mærkeligt fænomen er formodentlig forklares ved ufuldstændig (ved) afhængighed affinitet af lægemidlet - receptor til traneduktoru. For Eksempel, nalorfin partiel agonist opioid receptor-agonist virker på samme måde til at udfylde disse morfin receptorer, skønt svagere end den sidste. Samtidig er deres fælles ansøgning nalorfin svækker eller eliminerer virkningerne af morfin; specielt, elimineret deprimerende effekt af morfin på åndedræt. Isoprenalin - en sand agonist, og prenalterol - partiel agonist til β-adrenerge receptor. Ifølge den receptor teori, sand agonist kan inducere en maksimal reaktion, selv om det kun interagerer med den del af receptoren.
Specifikke receptorer kan være ens eller forskellige bindingssteder for agonister og antagonister. Forskellige bindingssteder for forskellige agonister. I det tilfælde, når agonisten og antagonisten er det samme bindingssted og den blokerende virkning af antagonisten på receptoren elimineres fuldstændigt ved at forøge agonistkoncentrationen (den maksimale virkning af agonisten), forholdet mellem antagonist og agonist omtales som kompetitiv antagonisme. Hvis bindingsstedet for agonisten og antagonisten er forskellige, forholdet mellem dem er defineret som en ikke-kompetitiv antagonisme. For at karakterisere antagonister bruges ofte indikator for pA2 (negative logaritme af den molære koncentration af antagonist, hvori for standard agonist virkning, bør dens koncentration fordobles).
I forbindelse med hele organismen agonister og antagonister forårsage ændringer af forskellige fysiologiske funktioner. Action antagonister således bestemte, de forhindrer indflydelse på specifikke receptorer tilsvarende naturlige ligander (f.eks, M-cholinerg receptorantagonist atropin inhiberer virkningen af acetylcholin-agonist). Ændringer, som er direkte forbundet med interaktionen af stoffer med specifikke receptorer, betegnet "primær farmakologisk respons, som kunne være begyndelsen på en række reaktioner, fører til stimulering eller inhibering af visse fysiologiske funktioner ".
Ændringer i funktionerne af organer eller systemer (f.eks, ændringer i styrke og hjertefrekvens, tonen i glatte muskler i indre organer, endokrine kirtler, HELVEDE, osv.), forårsaget af lægemidlet, benævnt farmakologiske effekter af stoffet. Så, hjerteglycosider for primær farmakologisk respons er hæmning af Na + -transport aktivitet, K-ATPase af myocardiale fibre, som betragtes som en mulig specifik receptor for cardioglycosider. I denne henseende K + forstyrret flow i muskelfibrene og output fibre af Na +, Ca2 + indhold forøget i cytoplasmaet i, der fremmer samspillet mellem actin og myosin. Resultatet af disse ændringer er at øge styrken af hjertets sammentrækninger, at den væsentligste farmakologiske virkning af cardioglycosider.
Langvarig udsættelse for specifikke receptorer agonister er ofte ledsaget af en reduktion af deres følsomhed. Sidstnævnte kan være forbundet med ændringer i receptorer, fald i deres antal (tæthed) eller overtrædelse af processerne, at følge receptorstimulering. I denne farmakologiske agonist virkninger blive mindre udtalte.
Således, farmakologiske virkninger af de fleste lægemidler er relateret til deres virkninger på de respektive specifikke receptorer.
Stoffer med høj affinitet for bioreceptors og lave iboende aktivitet kaldes antagonister, eller blokatorami, som de, uden at forårsage ændringer i kropsbygning bioreceptors, interferere med interaktionen med ham endogene og / eller exogene ligander agonister. Der er også såkaldte "sekundære eller mute receptorer, lægemidler, som binder, men ikke har en farmakologisk virkning. Disse "tavse" receptorer er mest ofte til stede i proteiner og blodplasma (men kan være i vævene). En forbindelse med "mute" receptor fører til et fald i koncentrationen af frit lægemiddel, og dermed nedbringe den terapeutiske virkning.
Talrige moderne teorier, forklarer mekanismen af ligandreceptorinteraktion, receptorer selv tilstand, manglende proportionalitet mellem antallet af besatte receptor og den endelige reaktion, ændringer i effektiviteten af signaltransmission og eksistensen af redundante receptorer og partielle agonister etc.. d. Det dannede grundlag for ideer om virkningsmekanismen af repræsentanter for forskellige grupper af stoffer. Disse interaktioner er klassificeret i interaktion med receptorer og kemisk interaktion.
Mekanisme af interaktionen af medikamenter med bioreceptors Det kan repræsenteres ved følgende skema: hver ligand (et lægemiddel eller en fysiologisk substrat) Det binder til et specifikt sted på en specifik receptor. Aktiverede receptorer direkte eller indirekte regulere strømmen af ioner (1) og / eller andre intracellulære processer (sekretion og muskelsammentrækning) eller aktiverer et system af proteiner guaninnukleotidsvyazyvayuschih (G-proteiner), hvad, på tur, forøger aktiveringen af second messenger-system-enzym. I cytoplasmaet er der flere forskellige anden messenger, fyring forskellige målproteiner, såsom protein- Kinazi. Den sidste virker på specifikke substrater og mediere den farmakologiske virkning.
Af den foreliggende beskrivelse kan ses, at virkningen af lægemidler udføres ved følgende mekanismer:
- fysiologisk vævsfunktion (f.eks, kontraktile, sekretoriske) kan reguleres af flere receptorer, og dermed, og forskellige ligander;
- interaktion mellem lægemidlet og receptoren vævet eller organet respons kan være flere mellemtrin, navnlig aktiveringen af receptorer associeret med det andet formidlende systemer;
- effektiviteten af mekanismerne, ansvarlig for sekvensen af stimulus-respons, og receptortæthed kan variere fra væv til væv.
Den terapeutiske virkning af visse lægemidler skyldes deres direkte (ikke bundet til specifikke receptorer) kemisk vekselvirkning med endogene forbindelser eller andre interaktionsmekanismer (osmolalitet, adsorption). Så for osmotiske diuretika - mannitol, urinstof - der er ingen specifikke receptorer. Disse stoffer øger osmotiske tryk i nyretubuli, derved forstyrret vand reabsorption og forøget diurese. Med specifikke receptorer er ikke forbundet handling adsorberende stof, forsurende diuretika.
Antacida (f.eks, aluminium- eller magnesiumhydroxider) omsættes med saltsyre for at danne med milde sure fødevarer. chelateringsmidler, bindes med visse metaller, inaktive form kemiske komplekser.
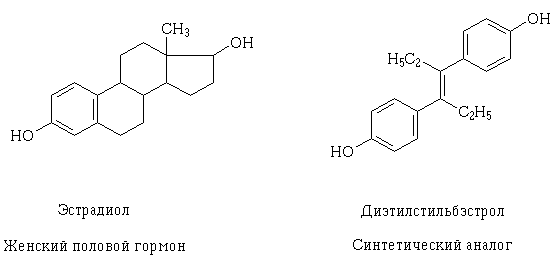
Med en uddybning af viden om strukturen og mekanismen for receptor potentielle farmakodynamiske lægemiddelinteraktioner på celleniveau er muliggjort deres målbevidst skabelse, samt en forklaring, hvorfor en sådan virkning kan have medicin, anderledes, ved første øjekast, dens struktur. Et eksempel på et sådant fænomen kan tjene østradiol og diethylstilbestrol trans - syntetisk analog af kvindelig seksuel. Deres strukturelle molekyler af forskellig, men indeholder de samme egenskaber og dimensioner funktionelle hydroxygrupper, på lignende måde placeret og orienteret i rummet, hvorved molekylerne af disse forbindelser kan interagere med den samme receptor og udøver lignende farmakologiske virkninger.
midler, at stoffer forårsage disse eller andre farmakologiske virkninger, betegnes "virkningsmekanismer". Dette koncept anvendes til at forklare virkningen af lægemidler på det molekylære, organ- og systemniveau. For Eksempel, anticholinsteraser virkningsmekanisme på molekylært niveau er reduceret til blokaden af acetylcholinesterase ved omsætning med en esterase og dets anioniske centre. På samme tid, forklarer mekanismen af den hypotensive virkning af anticholinsteraser, angivet som grund af denne effekt og vasodilatation bradykardi, t. Det er. overvejer mekanismen af denne virkning på organniveau.
Undersøgelse narkotika virkningsmekanismer er konstant, hvor afbildningen af virkningsmekanismen for et lægemiddelstof som nye data kan ikke kun blive mere detaljeret, men også variere betydeligt.
